CONTRIBUTO ALLA CONOSCENZA DELLE MICOFLORA DELLE TORBIERE ALPINE DI CASON DI LANZA (PAULARO - UD)
di Paolo Picciola*, Marino Zugna**
(*) Paolo Picciola - Strada di Fiume, 52 - 34137 Trieste (TS) - paolo.picciola2@gmail.com
(**) Marino Zugna - Località Rio Storto, 7 - 34015 Muggia (TS) - marinozugna@gmail.com
Introduzione
Tra gli aspetti più interessanti connessi al nostro interesse oramai pluridecennale per la micologia e forse, tra tutti, an- che il più intrigante è quello rappresentato dal fatto che le specie fungine crescono un po’ ovunque. I funghi, infatti, vivono in ambienti molto diversi, non solo nelle foreste di latifoglie e conifere, distribuite dalla pianura fino al piano montano o nelle aree prative, ma anche nei parchi cittadini, lungo i viali alberati, nelle dune marine, sulle rive ghiaiose di un fiume, nelle microselve alpine, nelle aree incendiate, etc. I funghi, inoltre, crescono su una vasta tipologia di substrati (sabbia, letame, terreni acidi o calcarei, residui legnosi bruciati, ceppaie, ramaglie, lettiere, su residui organici vari, radici, insetti, etc.) stabilendo inoltre, in base alle loro caratteristiche trofiche, dei rapporti con moltissime specie vegetali arboree, arbustive ed erbacee ma anche con numerose briofite, soprattutto muschi. La ricerca di numerose specie fungine pertanto può avvenire anche in particolari nicchie ecologiche e/o microambienti che nel loro complesso, a dispetto della loro limitata estensione, contribuiscono ad arricchire la biodiversità di un territorio.
Un ambiente che ha suscitato in noi l’interesse per la sua particolare e selettiva micoflora è rappresentato dalla torbiera. La torbiera possiamo definirla un ambiente particolarmente umido presente in aree caratterizzate da eccesso di acqua, siano esse sponde di laghi e fiumi o superfici piane e versanti ove scorre un sottile velo d’acqua (Minelli, 2004). La vegetazione è costituita in prevalenza da specie igrofile e acidofile (sfagni, muschi, ciperacee e graminacee) che, con le loro parti vegetali morte, danno origine ad un deposito organico Sporedecomposto ricco di carbonio, “torba”. La torba è prodotta dalla saturazione idrica associata ad una condizione di anaerobiosi, la quale limita fortemente i processi di decomposizione della sostanza organica in quella inorganica che viene svolta da batteri, funghi e altri organismi decompositori. La torbiera è considerata attiva se il processo di accumulo della torba è in atto e morta se tale processo è stato interrotto (Minelli, 2004).
Precisiamo che la nostra esposizione verte soltanto su un tipo di torbiera, la “torbiera alta” definita così per differenziarla dalla “torbiera bassa”, quest’ultima presente generalmente in aree a bassa o media piovosità, di solito in paludi di pianura, prati umidi, valli fluviali e il cui apporto idrico dipende dalla presenza della falda freatica, a differenza della “torbiera alta” il cui apporto idrico è alimentato dall’acqua piovana che scorre lentamente.
Nella fascia alpina della nostra regione le torbiere d’alta quota sono estremamente rare e localizzate. Oltre agli ambienti torbosi situati sui Piani di Lanza nel comune di Paularo, possiamo citare soltanto il biotopo della Torbiera di Pramollo, nel comune di Pontebba.
In Europa sono invece largamente distribuite nella fascia boreale, dove maggiori sono le precipitazioni e minore è l’evaporazione, tendono quindi a ridursi a mano a mano che si procede da nord verso sud. In Italia, queste delicate e preziose zone umide sono distribuite principalmente sulle Alpi e sull’Appennino settentrionale e diminuiscono drasticamente procedendo verso sud lungo la penisola. Nell’arco alpino le torbiere si localizzano in conche, vallate chiuse o declivi, in zone dove l’acqua scorre lentamente. Un elemento fondamentale di una torbiera è il tappeto verde e rosso-bruno di muschi e sfagni il cui spessore può andare da pochi centimetri ad alcuni metri e che, alla base può avere un’età di alcune centinaia di anni (Minelli, 2004). Gli Sphagnum crescono sulla superficie, mentre la sua parte inferiore muore e rimane accumulata, formando con il tempo la torba. Inoltre, lo strato di sfagni vivi è in grado di cambiare radicalmente le caratteristiche chimiche dell’ambiente ove si sviluppa, causandone una forte acidificazione (il PH è inferiore a 4,6). In virtù di queste condizioni chimiche estreme si sono instaurate piante tipicamente acidofile, come ad esempio il brugo (Calluna vulgaris), il mirtillo di palude (Vaccinum uliginosum), il pennacchio tondo (Eriophorum vaginatum) e alcune piante insettivore come la drosera (Drosera rutundifolia, Drosera anglica) e la pinguicola (Pinguicola alpina, Pinguicola vulgaris), etc. (Campo, 2007). Un’altra importante caratteristica della torba nonché dalla coltre superficiale degli sfagni è data dalla proprietà per entrambi di comportarsi come una vera “spugna”, permettendo così di trattenere una grandissima quantità d’acqua che un po’ alla volta viene rilasciata nel corso della stagione estiva. Tale proprietà è dovuta principalmente alla sua particolare struttura fogliare, costituita da grosse cellule internamente vuote con funzione di serbatoio che immagazzinando acqua e trasportandola per capillarità nelle parti più alte, ne permette l’accrescimento continuo.
In virtù dei suoi importanti elementi naturalistici e della sua complessità geologica, il sito nel quale sono state effettuate le raccolte fungine oggetto di questa trattazione, è stato inserito dalla regione FVG nella Rete Natura 2000 (Codice habitat 7110 – torbiere alte). Su questo sito, compreso l’intero territorio circostante, sono in vigore dal 25.04.2013 le misure di conservazione specifiche (MSC) finalizzate alla conservazione e alla tutela della biodiversità nell’ambito delle zone speciali di conservazione (ZSC) della regione biogeografica alpina del Friuli Venezia Giulia. L’area interessata dalle suddette misure di conservazione è denominata ZSC - IT 3320003 “Creta d’Aip e Sella di Lanza” ed è considerata un sito fondamentale per la conservazione delle torbiere di alta quota e degli alpeggi e si estende su una superficie complessiva di 3894 ettari.
Foto 1-2. Cason di Lanza - Paularo (UD)
Materiali e metodi
Le foto delle raccolte presentate in questo contributo sono state effettuate in situ mediante le fotocamere digitali Nikon D40 e D90. Sono stati descritti i caratteri macroscopici analizzando i basidiomi freschi. Lo studio dei caratteri microscopici è stato eseguito su materiale d’erbario che è stato preventivamente reidratato in acqua distillata o con una soluzione acquosa di idrossido di potassio (KOH) al 5%. e ove necessario, colorato con rosso Congo ammoniacale al 2 % per meglio evidenziare le differenti tipologie cellulari. Le foto concernenti la microscopia, sono state eseguite con l’ausilio di una fotocamera Reflex EOS 50D, posta sul terzo occhio del trinoculare di un microscopio biologico Optech Biostar B5, supportato da ottiche Plan-APO, illuminazione alogena 12V-50 W a luce riflessa con regolatore d’intensità. Le misure microscopiche sono state eseguite con il software di calcolo Mycométre scaricabile all’indirizzo http://mycolim. free.fr. Laddove si dispone di più raccolte per specie, i parametri sporali riportati (le misure medie, Qm, Vm) sono ricavati dal totale delle misurazioni effettuate su più raccolte. Per le rimanenti strutture si sono eseguite un minimo di venti misure a tipologia. Per la terminologia riguardante la tipologia delle caratteristiche macro e microscopiche si fa riferimento a Vellinga (1988). Per quanto riguarda la nomenclatura delle specie presentate si è fatto riferimento alle indicazioni contenute nei siti http:// www.indexfungorum.org e http://www.mycobank.org.
Gli exsiccata sono depositati nell’erbario del gruppo micologico A.M.B. di Muggia e del Carso.
Le specie fungine rappresentate vengono descritte e commentate con il supporto di fotocolor dei basidiomi in habitat e dei principali caratteri microscopici le seguenti specie:
- Galerina paludosa;
- Galerina tibiicystis;
- Hypholoma elongatum;
- Hygrocybe coccineocrenata;
- Simocybe laevigata.
Le specie qui presentate sono esclusive della torbiera a sfagni e pertanto la loro distribuzione nel territorio regionale è relegata ad alcune stazioni circoscritte della fascia montana d’alta quota, caratterizzate dalla presenza di Sphagnum spp. e di Ciperaceae (Carex, Eriophorum) ed in generale da specie acidofile e igrofile che si sono adattate a vivere in ambienti molto poveri di nutrienti. Le prime quattro specie sono piuttosto comuni e caratteristiche di questo habitat, mentre l’ultima specie, sulla base delle nostre conoscenze, dovrebbe essere considerata piuttosto rara e della quale non siamo a conoscenza di alcun ritrovamento documentato sul territorio nazionale. Come vedremo in questo contributo, la presenza di Simocybe laevigata nella torbiera di Lanza, a differenza delle altre specie, non è legata agli steli e alle foglie dello sfagno che si accumulano sul fondo della torbiera, bensì alla presenza di residui fogliari delle Ciperaceae (Carex pauciflora, Eriophorum vaginatum) che in questo sito sono particolarmente abbondanti.
Tassonomia
Galerina paludosa (Fr.) Kühner, Encyclop. Mycol. 7: 184 (1935)
Basionimo = Agaricus paludosus Fr., Epicr. syst. mycol. (Upsaliae): 209 (1838)
Sinonimi = Galera paludosa (Fr.) P. Kumm., Führ. Pilzk. (Zerbst): 75 (1871)
= Tubaria paludosa (Fr.) P. Karst., Bidr. Känn. Finl. Nat. Folk 32: 445 (1879)
= Pholiota paludosa (Fr.) Pat., Hyménomyc. Eur. (Paris): 116 (1887)
= Naucoria paludosa (Fr.) Henn., in Engler & Pran- tl, Nat. Pflanzenfam., Teil. I (Leipzig) 1(1**): 250 (1898)
= Galerula paludosa (Fr.) A.H. Sm., Pap. Mich. Acad. Sci. 20: 175 (1935)
= Hydrocybe paludosa (Fr.) M.M. Moser, in Gams, Kl. Krypt.-Fl. Mitteleuropa - Die Blätter- und Bauchpilze (Agaricales und Gastromycetes) (Stuttgart) 2: 181 (1953)
= Agaricus paludosus var. stygius Fr., Epicr. syst. mycol. (Upsaliae): 209 (1838)
= Tubaria paludosa f. limosa Sacc., Syll. fung. (Abel- lini) 5: 873 (1887)
Pileo 5-20(22) mm, esiguo, 0,5 mm di spessore, da conico-campanulato a convesso, mai completamente spianato, con evidente umbone mammellonato, margine a lungo involuto, inizialmente crenulato, superficie liscia, igrofana, quando idratata di aspetto viscido, nettamente striata radialmente per trasparenza fin quasi al centro, ornata di residui velari araneoso-fibrillosi di colore bianco che spariscono velocemente lasciando il cappello glabro, di colore inizialmente uniforme, ocra-aranciato brillante, giallo-brunastro, impallidente per disidratazione sui toni del beige o del nocciola chiaro a partire dal margine.
Lamelle da adnato-annesse a smarginate, brevemente decorrenti per un dentino, ventricose, alte fino a 3-4 mm, relativamente spesse, un po’ spaziate, intervallate da lamellule, dapprima ocra chiare, poi giallo-brunastre, infine bruno-rossastre, filo lamellare che rimane più chiaro e finemente crenulato.
Stipite 40-85 x 2-3 mm, cilindrico, sottile, allungato, fistoloso, solitamente ondulato, fragile, superficie finemente fibrillosa longitudinalmente per tutta la lunghezza, ocracea, pallidescente alla base, decorata da fioccosità biancastre del velo generale disposte a bande zigzaganti, glabrescente con l’età, anello posto molto in alto, sottile, di consistenza araneoso-fibrillosa, bianco, effimero; superficie sopra l’anello ocra-aranciata, un po’ più scura, cosparsa da una forfora biancastra.
Carne molto esigua, fibrosa nello stipite, acquosa e di aspetto vitreo, più o meno concolore alle superfici e tendente anch’essa a decolorare per disidratazione, inodore e insapore. Sporata bruno rossastra.
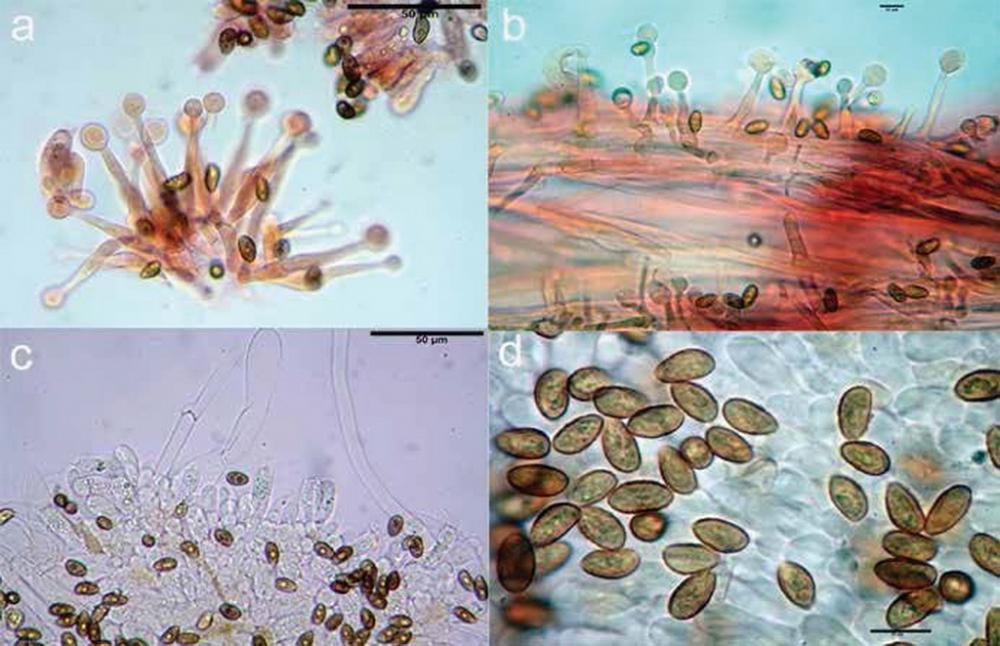
S.p.o.r.e. (7,4)8,8-10,7(12,7) x (5,0)5,8-6,5(7,3) μm, in media 9,9 x 6,1 μm, Q.= 1,3-2,0, Q.m. = 1,6; Vol.m.= 198,1 μm³ (n = 242, 5 raccolte), destrinoidi, cianofile, ampiamente ovoidali in visione frontale, largamente amigdaliformi in visione laterale, con apice ottuso in visione frontale, perlopiù conico acuto in visione laterale; superficie da liscia a finemente verrucosa, di colore ocra carico in acqua, con plaga ilare evidente, ma non sempre ben delineata.
Basidi (15,0)15,9-19,5(20,1) x (4,5)4,8-6,7(6,9) μm, in media 17,8 x 5,5 μm, claviformi, tetrasporici.
Cheilocistidi (26,0)26,9-44,1(47,6) x (4,2)6,0-9,3(9,8) μm, in media 34,6 x 7,6 μm, molto numerosi, ialini, di forma variabile, da utriformi a lageniformi, fusoidi-ventricosi, ventricosi, clavati, con apice ottuso oppure con capitulo largo 9-14 μm, collo generalmente breve, lungo in media 8 μm. Pleurocistidi assenti.
Caulopellis composta da ife parallele, larghe (2,5)3,3-7,0(7,3) μm, in media 4,6 μm, con pigmento parietale brunastro.
Caulocistidi (29,0)32,0-50,2(53,8) x (2,9)3,0-7,9(8,9) μm, in media 40,2 x 5,2 μm, lunghezza collo (7,1)8,0-12,4(14,1) μm, in media 10,1 μm, numerosi.
Trama lamellare regolare, composta da ife brevi, con giunti a fibbia ai setti.
Pileipellis di tipo cutis, formata da ife larghe (2,0)2,3 -5,0(5,8) μm, larghe in media 3,5 μm, più o meno parallele, sovente attenuate ai setti, con pigmento parietale bruno finemente incrostato.
Giunti a fibbia presenti ovunque in abbondanza, anche alla base dei cheilocistidi.
Materiale studiato
Italia. F.V.G. Udine. Comune: Paularo. Località: Cason di Lanza. Coordinate geografiche: 46º34’23’’ N 13º10’08’’ E. Altezza 1707 m s.l.m. Raccolte: 31.07.2003 (n° 1717). Legit. F. Bersan & det. M. Zugna; 31.08.2009 (n° 6218). Legit. & det. P. Picciola & F. Bersan; 22.07.2016 (n°6749). Legit. P. Picciola, F. Bersan, D. Persoglia, L. Andreuzi e R. Violin; det. P. Picciola & M. Zugna. 20.07.2019 (n° 7864). Legit. & det. P. Picciola. Materiale aggiuntivo: Slovenia. Comune: Maribor. Località: Rogla. Coordinate geografiche: 46°27’13”N 15°19’53”E. Altezza 1500 m. s.l.m.
Habitat: in zona prativa, su terreno adibito a pascolo con presenza di sfagno. Raccolta: 20.08.2005 (n° 2839). Legit. M. Zugna, G. Lui, A. Picinin; det. M. Zugna.
Osservazioni
Ampiamente rappresentato nelle torbiere a sfagni è il genere Galerina, le cui specie sono caratterizzate da una monotonia di forme, dimensioni e tinte, sicché, per poterle determinare, è necessario quasi sempre il ricorso alla microscopia. Sono funghi di piccole e medie dimensioni, dall’aspetto micenoide o naucorioide, con colorazioni generalmente giallo-ocracee oppure ocraceo-rugginose, con la superficie pileica igrofana e più o meno striata per trasparenza, il gambo con o senza velo, la sporata ocraceo-rugginosa, la cuticola composta da ife radiali con pigmento incrostante, le Sporeda lisce a verrucose, con plaga presente o meno, raramente con poro germinativo, quasi sempre cianofile e destrinoidi, alcune con esosporio che si stacca dall’episporio (caliptratura), i cistidi sempre presenti sul filo lamellare, spesso anche sulla faccia lamellare, ma anche su gambo e pileo, con o senza giunti a fibbia; crescenti un po’ dappertutto: su muschio, legno muscoso, legno in disfacimento o raramente su terreno (Smith & Singer, 1964; Lonati, 1998; Curti & Musumeci, 2005). Galerina paludosa è la più frequente tra le numerose Galerina presenti nelle torbiere, tra gli sfagni vivi e tipicamente sani, dove non si è ancora a conoscenza della loro attività esercitata sugli stessi se di tipo parassitaria o saprofitica (Redhead, 1981; Moreau, 1992; Padovan F. et al. 2020). Tra le numerose Galerina che crescono in questo habitat, può essere facilmente riconosciuta già sul campo per alcuni caratteri macroscopici peculiari che se attentamente osservati possono rilevarne la sua identità. Galerina paludosa, infatti, nelle fasi giovanili di crescita, è avvolta dal velo generale, i cui residui rimangono sia sulla superficie pileica sotto forma di elementi araneoso- fibrillosi, sia sulla superficie stipitale, la quale è caratteristicamente decorata da numerose bande sovrapposte costituite da fioccosità biancastre e che verso l’apice dà origine ad una netta zona anulare di aspetto feltroso. Altri elementi che concorrono alla sua determinazione sono le colorazioni dei basidiomi, il cappello conico-campanulato e la sua superficie nettamente striata a tempo umido. I dubbi invece sorgono quando G. paludosa si presenta priva del tutto o quasi dei residui velari che la ricoprivano nelle fasi iniziali di crescita. In questi casi è necessario la verifica dei suoi caratteri microscopici. Sul piano microscopico infatti questa specie si caratterizza per le Sporenon caliptrate, con plaga ilare evidente, sebbene non sempre ben definita, la superficie da liscia a finemente verrucosa, nonché dalla forma ovoidale in visione frontale che diviene largamente amigdaliforme in visione laterale. I cistidi imeniali sono presenti solo sul filo lamellare ed hanno una forma piuttosto variabile, predomina la forma lageniforme, spesso terminante con un capitulo, ma non mancano quelli fusoidi-ventricosi oppure clavati. Smith & Singer (1964) nella loro monografia mondiale dedicata a questo genere, includono questa specie nella stirpe Sphagnorum che comprende specie dotate di velo, con cheilocistidi con collo spesso 3 μm o anche più, stipite piuttosto lungo per la sua crescita nei profondi tappeti muschiosi, le Sporeda lisce o quasi, nella subsezione Mycenopsidae che comprende specie con cheilocistidi aventi dei colli più spessi di quelli della subsezione Tibiicystidiae, nella sezione Mycenopsis che include specie a Sporenon caliptrate, con superficie pileica igrofana e tipicamente viscida a tempo umido, Sporeprive di poro germinativo, pleurocistidi assenti e plaga ilare non rilevabile in presenza di Sporelisce, nel subgenere Galerina che include tutte le Galerina con giunti a fibbia e Sporecon plaga liscia. Galerina paludosa, quando si presenta priva di residui velari, può essere facilmente confusa con Galerina sphagnicola (G.F. Atk.) A.H. Sm. & Singer, che come suggerisce il suo nome si associa strettamente all’ambiente di torbiera con sfagni. Questa entità, tuttavia, appartiene alla Sezione Calyptrospora Smith & Singer che aggrega specie con Sporecaliptrate. La lacerazione dell’esoperidio sporale, sotto forma di vesciche, avviene vicino alla plaga ilare. La specie inoltre si caratterizza per le colorazioni fulve nei giovani esemplari e la presenza di un velo molto più discreto, i cui resti spariscono velocemente sul cappello e nella parte superiore del gambo, a differenza di G. paludosa, i cui resti, come abbiamo visto, permangono in maniera evidente sulle superfici di gambo e cappello. Altra specie sfagnofila strettamente affine a G. paludosa e anch’essa inclusa nella stirpe Sphagnorum è G. sphagnorum (Pers. :Fr.) Kühn la quale differisce da G. paludosa essenzialmente per l’assenza di velo.
Fig 3. Galerina paludosa. Foto in habitat.
Fig 4. Galerina paludosa: a) cheilocistidi; b) giunto a fibbia imeniale; c) spore; d) foto in habitat.
Galerina tibiicystis (G.F. Atk.) Kühner, Encyclopédie Mycologique 7: 176 (1935)
Basionimo = Galerula tibiicystis G.F. Atk., Proceedings of the American Philosophical Society 57: 365 (1918)
Sinonimi = Galera tibiicystis (G.F. Atk.) A. Pearson, Transactions of the British Mycological Society 35 (2): 113 (1952)
Pileo (7)12-23 mm, sottile, fragile, da emisferico a conico-campanulato, poi convesso, infine disteso, con largo umbone mammellonato ben evidente quando il pileo è disteso, margine involuto, finemente crenulato, superficie glabra, liscia, viscida e brillante, ma non viscosa, fortemente igrofana, nettamente striata per trasparenza fino al disco, completamente priva di residui velari, di colore giallo-aranciato, ocra-arancio, poi tendente all’ocra chiaro con la disidratazione.
Lamelle arrotondate annesse, piuttosto spaziate, alte fino a 3-4 mm, ventricose, intercalate da 5-8 lamellule di varia lunghezza, crema-ocracee, poi ocracee con il filo regolare, finemente fimbriato, biancastro da giovane, ma più scuro con la maturazione.
Stipite 40-80 x 4 mm, cilindrico, slanciato, fistoloso, fragile, flessuso vista la lunghezza, superficie liscia, con fini fibrille longitudinali concolori al fondo, di colore meno sgargiante del pileo, sui toni del grigio-beige, beige-giallastro, ricoperta su tutta la lunghezza da una pruina bianca, che tende a svanire con la manipolazione e con la vecchiaia, spesso più evidente e persistente all’apice, priva di velo e con la base avvolta da una feltratura miceliare bianca.
Carne sottile, fibrosetta nello stipite, concolore alle superfici, tendente a decolorare con la disidratazione, inodore e di sapore mite. Sporata non ottenuta.
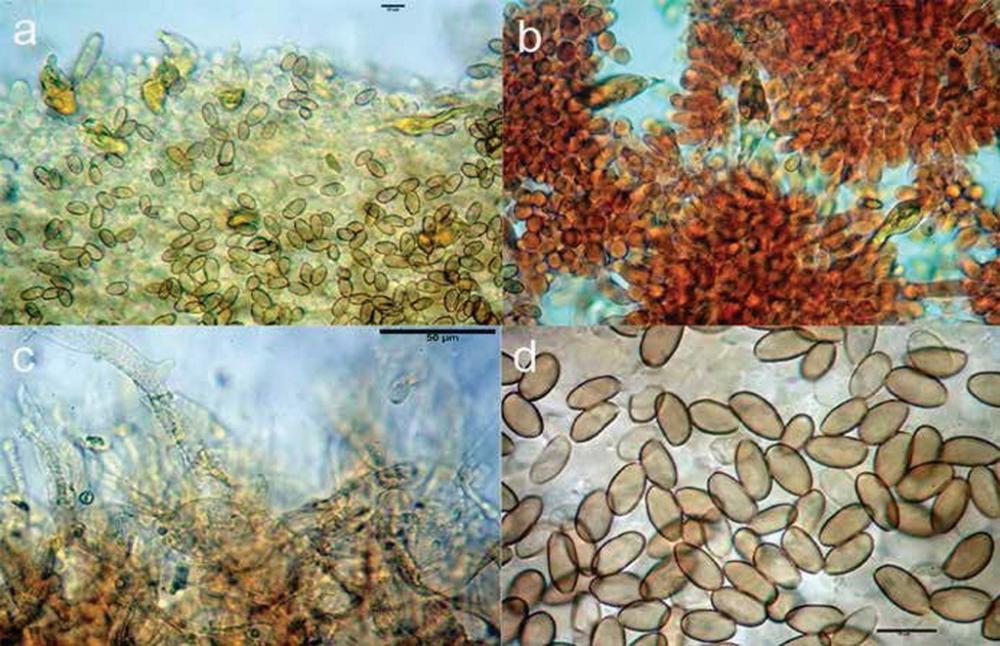
S.p.o.r.e. (8,9)9,5-10,7(11,3) x (4,8)5,0-5,6(5,8) μm, in media 9,8 x 5,1 μm, Q. = (1,6)1,7-2,0 (2,1), Q.m. = 1,9, Vol.m. = 139 μm3, (n = 250, 4 raccolte), ovoidali in visione frontale, amigdaliformi in visione laterale, con esosporio verrucoso-rugoloso, plaga quasi liscia o in alcuni casi con contorni indefiniti, giallastro-rugginose in KOH.
Basidi (26,4)27,5-31,1(31,8) x (7,5)7,9-9,4(9,7) μm, in media 30,8 x 9,0 μm, clavati, tetrasporici, con giunti a fibbia.
Cheilocistidi (31,5)35,5-50,5(56,8) x (3,3)4,9-7,9(9,3) μm, in media 40,3 x 6,7 μm, Qm = 6,9, numerosi, ialini, tibiiformi, con capitulo di diametro (1,9)4,3-8,7(10,8) μm, largo in media 8,2 μm. Pleurocistidi non osservati.
Pileipellis di tipo cutis, formata da ife filamentose, cilindriche con diametro (2,6)2,9- 5,2(5,7) μm, in media 5,0 μm, incrostate da un pigmentato giallastro, terminali poco differenziati nel diametro o appena allargati all’apice; subpellis poco differenziata, formata da ife cilindriche con diametro (1,9)4,3-9,2(13,5) μm, in media 5,6 μm, solo leggermente pigmentate e finemente incrostate. Pileocistidi rari.
Trama lamellare regolare, formata da ife settate, di forma cilindrica, con diametro (4,5)5,8-14,6(17,3) μm, larghe in media 8,3 μm, ialine o leggermente pigmentate di bruno-giallastro, parete finemente incrostata.
Caulopellis formata da ife cilindriche, parallele, larghe (2,9)3,1-6,6(7,2) μm, in media 3,8 μm, settate, ialine o leggermente pigmentate di bruno-giallastro, parete finemente incrostata.
Caulocistidi (27,9)32,9-60,4(72,6) x (2,6)3,3-8,5(9,7) μm, in media 45,3 x 4,5 μm, Q.m = 7,2; numerosi, ialini, a parete sottile, simili ai cheilocistidi per forma ma tendenzialmente più slanciati e sottili, con bulbillo di diametro (1,9)4,3-9,2(13,5) μm, largo in media 5,5 μm. Giunti a fibbia abbondanti in tutti i tessuti.
Materiale studiato
Italia. F.V.G. Udine. Comune: Paularo. Località: Cason di Lanza. Coordinate geografiche: 46º34’23’’ N 13º10’08’’ E. Altezza 1707 m s.l.m. Raccolte: 31.07.2003 (n° 1733). Legit. F. Bersan & det. M. Zugna; 22.07.2016 (n° 6748). Legit. P. Picciola, F. Bersan, D. Persoglia, L. Andreuzi e R. Violin; det. P. Picciola & M. Zugna; 20.07.2019 (n°7865). Legit. P. Picciola & det. M. Zugna; 20.07.2019 (n°7867). Legit. P. Picciola; det. M. Zugna & P. Picciola.
Osservazioni
Galerina tibiicystis è un’altra specie tipica di questo habitat che non di rado si rinviene frammista ad altri esemplari di G. paludosa. A livello macroscopico le due specie sono sostanzialmente identiche, l’unica differenza importante risiede nell’assenza di velo in G. tibiicystis e nella presenza dello stesso in G. paludosa. Differenze importanti tra i due taxa emergono perlopiù nei caratteri microscopici, per la forma dei cheilo e caulocistidi in G. tibiicystis caratteristicamente tibiiformi (come suggerisce il nome della specie), mentre in G. paludosa gli stessi sono da lageniformi a fusoidi-ventricosi. Anche le Sporepresentano delle rimarchevoli differenze. G. paludosa possiede Sporemediamente più larghe, in visione frontale largamente ovoidali e in visione laterale largamente amigdaliformi (Q.m. = 1,6), mentre quelle di G. tibiicystis sono ovoidali in visione frontale e strettamente amigdaliformi in visione laterale (Q.m. = 1,9), conferendo così alla spora di G. tibiicystis un aspetto più allungato sebbene le dimensioni medie di entrambe le specie siano sovrapponibili.
Fig 5. Galerina tibiicystis. Foto in habitat.
Fig 6. Galerina tibiicystis: a) cheilocistidi; b) caulocistidi; c) basidi e giunto a fibbia; d) spore.
Hypholoma elongatum (Pers.: Fr.) Ricken, Die Blätterpilze 1: 250 (1915)
Basionimo = Agaricus elongatus Pers., Icones et Descriptiones Fungorum Minus Cognitorum 1: 3, tab. 1, fig. 4 (1798)
Sinonimi = Psilocybe elongata (Pers.) J.E. Lange, Dansk botanisk Arkiv 9 (1): 30 (1936)
= Geophila elongata (Pers.) Kühner & Romagn., Flore Analytique des Champignons Supérieurs: 334 (1953)
= Naematoloma elongatum (Pers.) Konrad, Bull. Mens. Soc. Linn. Lyon: 135 (1929)
= Naucoria obtusissima Kauffman, Papers of the Michigan Academy of Sciences 17: 188 (1933)
= Agaricus elongatipes Peck, Annual Report on the New York State Museum of Natural History 29: 40 (1878)
= Psilocybe elongatipes (Peck) Sacc., Syll. Fung. 5: 1046 (1887)
= Hypholoma elongatipes (Peck) A.H. Smith, Mycologia 33 (1): 5 (1941)
= Naematoloma elongatipes (Peck) Singer, Lilloa 22: 504 (1951)
= Pholiota elongatipes (Peck) A.H. Smith & Hesler, The North American species of Pholiota: 143 (1968)
= Agaricus udus [“var.”] elongatus (Pers.: Fr.) Fr., Systema Mycologicum 1: 292 (1821)
= Psilocybe uda var. elongata (Pers.) Gillet, Les Hyménomycètes ou Description de tous les Champignons qui Croissent en France 1: 586 (1878)
Pileo 8-20(30) mm, emisferico, poi convesso-campanulato, infine spianato, sottile, privo di umbone o appena accennato, con il margine dapprima involuto, poi diritto, ondulato, superficie liscia, igrofana, a tempo umido subviscida e striata per trasparenza per 2/3 del raggio, di colore giallastro, giallo-ocra, ocra-brunastro, tendente a impallidire per disidratazione, margine con residui velari fioccosi evanescenti di colore bianco.
Lamelle da adnate a profondamente smarginate, da fitte a moderatamente spaziate, biancastre, poi grigiastre, infine grigio-brune, prive di evidenti tonalità violaceo-porpora quando mature, brune negli exsiccata, filo concolore, intero o leggermente fimbriato.
Stipite 30-160 x 2-4 mm, cilindrico, sottile, molto slanciato (inde nomen), sinuoso, fistoloso, di aspetto vitreo, da giallastro a rossastro nella parte mediana e inferiore, apice biancastro, ricoperto da residui fugaci del velo parziale sotto forma di fini fioccosità che aderiscono alla superficie e che ricoprono inizialmente le lamelle sotto forma di un sottile anello araneoso, i cui resti si ritrovano anche sul margine pileico.
Carne esigua, concolore alle superfici; odore indistinto e sapore leggermente amaro. Polvere sporale di colore grigio-bruno.
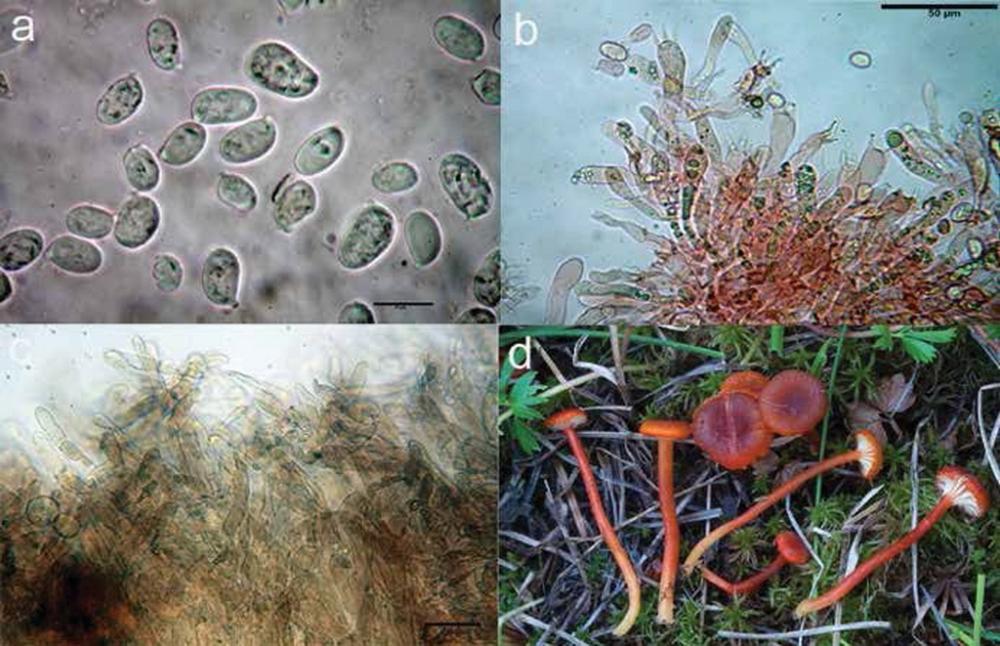
Spore (8,5)9,3- 11,0(12,4) x (4,4)4,6-5,8 (7,1) μm, in media 10,2 x 5,6 μm, Q. = 1,5-2,3, Q.m. = 1,8, Vol.m. 176,8 μm³, (n = 100, 2 raccolte), da ellissoidali a oblunghe in visione laterale, lisce, con parete relativamente sottile, con poro germinativo centrale, piccolo, alcune volte indistinto, di colore bruno pallido se osservate in KOH, gialle in acqua. Filo lamellare sterile, composto da cheiloleptocistidi e da cheilocrisocistidi.
Cheiloleptocistidi da subclavati a strettamente lageniformi, con apice subcapitulato, ialini, con parete sottile, numerosi.
Cheilocrisocistidi (37,6)38,7-58,0(61,2) x (10,4)10,8-14,8(16,3) μm, in media 48,1 x 12,7 μm, Q.m. = 3,8 μm, clavati, con apice mucronato-rostrato o capitulato, base che ter- mina con un peduncolo.
Pleurocrisocistidi simili ai cheilocrisocistidi.
Pleuroleptocistidi non visti. Basidi (21,2)22,8-31,5(31,6) x (7,4)7,5-9,2(9,3) μm, clavati, attenuati nella parte mediana, tetra- sporici.
Pileipellis composta da una sottile cutis di ife strette con pareti incrostate larghe (1,9)2,6- 6,0(7,6) μm, in media 4,3 μm.
Caulopellis formata da una cutis di ife cilindriche, con pareti generalmente ialine, larghe (1,6)2,5- 4,9(6,2) μm, in media 3,6 μm.
Caulocistidi (22,8)23,3-41,6(41,7) x (7,8)7,9-11,1(11,3) μm, in media 32,5 x 9,31 μm, da clavati a capitulati, con apice largo fino a 18 μm, numerosi, a gruppi all’apice del gambo.
Giunti a fibbia osservati in abbondanza in tutti i tessuti.
Habitat torbiera alta, su Sphagnum. Materiale studiato Italia. F.V.G. Udine. Comune: Paularo. Località: Cason di Lanza. Coordinate geografiche: 46º34’23’’ N 13º10’08’’ E. Altezza 1707 m s.l.m.
Raccolte: 22.08.2008 (n° 6482). Legit. P. Picciola & F. Bersan. Det. M. Zugna. 31.08.2009 (n° 6247). Legit. P. Picciola. Det. M. Zugna.
Osservazioni
Per la silhouette e le colorazioni complessive questo Hypholoma può essere facilmente scambiato sul campo per una Galerina s.l. La difficoltà nella sua identificazione a livello di Genere è dovuta principalmente al fatto che le lamelle, anche da mature, sono prive di tonalità violaceo-porporine tipiche degli Hypholoma; negli exsiccata infatti conservano una colorazione brunastra. Ogni dubbio cessa grazie alla microscopia che immediatamente svela la sua identità. Infatti, come in tutte le Strophariaceae, anche questa specie presenta nell’imenio, ma anche nella caulopellis, particolari cistidi, detti crisocistidi. Questi particolari cistidi si riconoscono principalmente per il loro contenuto, generalmente sotto forma di un grande vacuolo o di più vacuoli, che si colora di giallo-oro (dal greco chrysós = giallo) se immersi in soluzioni di idrato di potassio o di ammoniaca. Di solito possiedono una forma clavata o più o meno fusiforme, i corpuscoli interni, invece, sono generalmente localizzati nella parte centrale o alla sommità del cistidio. Per un preliminare riconoscimento sul campo, a nostro giudizio è necessario prestare attenzione al colore biancastro delle lamelle nei giovani esemplari, carattere che aiuta a separare preliminarmente questa specie dalle Galerina, le cui lamelle anche nei giovani esemplari presentano delle tonalità ocracee. Importante segnalare che a livello microscopico il filo lamellare risulta essere sterile per la contemporanea presenza di due tipologie di cistidi, i cheilocrisocistidi, i quali sono stati appena menzionati, e i cheiloleptocistidi, ben differenziabili dai primi per essere completamente ialini, e strettamente lageniformi con un apice subcapitulato. Noordeloos (2011) include Hypholoma elongatum nella Sottosezione Elongata, selezionandolo come la specie tipo della suddetta sottosezione, al cui interno ha incluso le specie con evidenti toni gialli, le lamelle prive per l’appunto di tonalità porporine e per le Sporeche risultano pallide quando osservate al microscopio, con la parete generalmente sottile e con il poro germinativo generalmente piccolo o indistinto. Come tutti gli Hypholoma, è da ritenere una specie saprotrofa, tipica degli ambienti umidi, quali paludi e torbiere, dove è possibile rinvenirla solitamente in piccoli gruppi. Noordeloos (2011) non la considera una specie strettamente sfagnicola, poiché la segnala su altri muschi appartenenti ai generi Drepanocladus, Polytrichum. Nella nostra regione è una specie da considerare rara in quanto circoscritta ai pochi ambienti umidi con Sphagnum. Prima di concludere i nostri commenti su questa interessante specie si vuole accennare al fatto che alcuni taxa appartenenti alla Sottosezione Elongata necessitano di ulteriori studi specifici e pertanto non è da escludere la possibilità che in futuro possano essere creati nuovi taxa sulla base di dati molecolari e morfologici.
Fig 7. Hypholoma elongatum. Foto in habitat.
Fig 8. Hypholoma elongatum: a) cheilocrisocistidi; b) pleurocrisocistidi; c) pileipellis; d) spore.
Hygrocybe coccineocrenata (P.D. Orton) M.M. Moser, Kleine Kryptogamenflora von Mitteleuopa - Die Blätter- und Baupilze (Agaricales und Gastromycetes) IIb/2: 68 (1967)
Basionimo = Hygrophorus coccineocrenatus P.D. Orton, Trans. Brit. Mycol. Soc., 1960, 43: 262.
Sinonimi = Pseudohygrocybe coccineocrenata (P.D. Orton) Kovalenko, 1988.
Pileo 8-17 mm, piuttosto piccolo, esiguo, presto spianato, con leggera depressione al centro, orlo ricurvo, crenulato, superficie asciutta, inizialmente bicolore, di colore rosso scarlatto al centro e giallo cadmio al margine, presto interamente rosso scarlatto o rosso cinabro, può sbiadire verso l’arancio a tempo asciutto e ventoso, costituita da minuscole squamette più appressate al disco, più rade verso il margine, dapprima concolori al fondo, ma presto brunastre, infine bruno-nerastre.
Lamelle arcuato- decorrenti, non molto larghe, spaziate, intercalate da 1-2 lamellule, con occasionali biforcazioni, biancastre, sovente con sfumature giallastre, immutabili anche dopo diverse ore dalla raccolta.
Stipite 30- 55 x 2-3 mm, cilindrico, fistoloso, slanciato, liscio, asciutto, lucente, fibrilloso, da giallo cadmio a rosso cinabro, base più sbiadita che mantiene una colorazione giallastra o giallo-aranciata.
Carne sottile, da aranciata a giallastra, acquosa, presto asciutta, inodore e insapore.
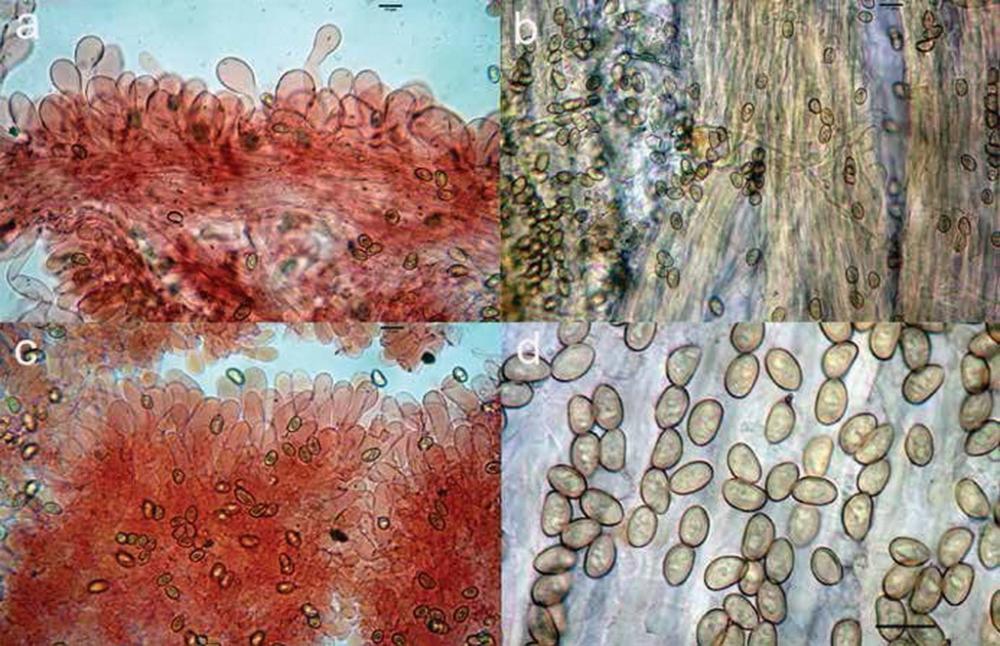
S.p.o.r.e. (7,5)8,3-11,7(12,5) x (4,6)5,3-7,4(7,9) μm, in media 9,9 x 6,1 μm, Q. = (1,3)1,4-1,8(2,0), Q.m. = 1,6, Vol.m. = 201,8 μm3, ellittiche, alcune leggermente strozzate al centro, ialine, a parete sottile.
Basidi (29,7)36,5 x 54,9(55,8) μm, in media 47,0 x 9,5 μm, claviformi, generalmente tetrasporici.
Pileipellis composta da una cutis di ife lunghe (49,6)60,1-115,9(121,5) μm, e larghe (8,9)10,1 -17,7(18,5) μm.
Caulopellis composta da ife parallele, a parete liscia, lunghe (91,5)108,8-342,4(449,8) μm e larghe (8,9)11,0-28,6(30,5) μm.
Giunti a fibbia presenti.
Materiale studiato
Italia. F.V.G. Udine. Comune: Paularo. Località: Cason di Lanza. Coordinate geografiche: 46º34’23’’ N 13º10’08’’ E. Altezza 1707 m s.l.m. Raccolte: 31.08.2009 (n° 6220. 31.07.2003 (n° 1693). Legit. & det. F. Bersan. 20.07.2019 (n° 7866). Legit. & det. P. Picciola.
Osservazioni
Hygrocybe coccineocrenata è una graziosa e colorata specie caratteristica delle torbiere alte, crescente a gruppi di diversi esemplari sui cuscini di Sphagnum spp. I suoi caratteri più affidabili che consentono di riconoscerla con certezza sono costituiti oltre che dall’habitat peculiare, dal portamento cantarelloide, dalle piccole dimensioni pileiche che non oltrepassano i 20 mm di diametro, dal colore sgargiante di cappello e gambo, che spazia dal giallo cadmio (presente dalle nostre osservazioni solo al margine pileico nei giovanissimi esemplari!) al rosso- aranciato fino al rosso scarlatto o rosso cinabro, dalle lamelle bianche, immutabili, spesso sfumate di giallastro e dalle squamette pileiche nettamente discolori, che diventano presto brunastre, fino a bruno-nerastre. Analizzando gli esemplari delle nostre raccolte abbiamo rilevato un cambiamento cromatico delle squamette che si è accentuato con la disidratazione. Infatti, diverse ore dopo la raccolta, gli esemplari da noi esaminati si presentavano uniformemente bruno-nerastri ad eccezione del margine pileico che conservava ancora i colori iniziali rosso-aranciati sebbene più sbiaditi di prima per la mancanza o la scarsità di dette squamette. La specie che più si avvicina a H. coccineocrenata a tal punto da essere considerata da alcuni autori un suo sinonimo anteriore è senza dubbio Hygrocybe turunda (Fr.) P. Karst. Va premesso che le differenze tra i due taxa si basano su alcuni piccoli dettagli che spesso risultano piuttosto labili ed incostanti. Per prima cosa va considerato il loro diverso habitat: H. coccineocrenata cresce nelle zone torbose costituite da Sphagnus spp., mentre H. torunda cresce nei prati umidi e muschiosi di montagna, spingendosi fino alla microselva. Inoltre, H. turunda, a differenza della specie sfagnicola, si caratterizzata per i colori da gialli a giallo-aranciati, mai rossi, dalle lamelle gialline o giallo cromo già nei giovani esemplari. Entrambi i taxa presentano delle micro squame discolori che diventano bruno-nerastre con la maturazione e con la disidratazione. Altra specie che condivide con H. coccineocrenata le medesime colorazioni e lo stesso portamento è Hygrocybe cantharellus (Schwein.) Muttill (= H. lepida Arnolds).
A differenza della maggioranza delle Hygrocybe che sono legate agli ambienti praticoli, H. cantharellus può crescere anche all’interno dei boschi umidi e muschiosi di montagna, sebbene sia più frequente rinvenirla nei prati, dalla pianura alla montagna. Il suo cappello può raggiungere facilmente i 30 mm di diametro, il margine pileico si presenta distintamente crenulato anche negli esemplari maturi, la zona centrale risulta più depressa, quasi ombelicata, la superficie è decorata da squamette che in questo caso rimangono concolori al fondo, infine le lamelle sono giallastre o bianco-giallastre, fortemente arcuato-decorrenti. Come in gran parte di queste Hygrocybe il cappello può spaziare dal rosso-arancio fino al giallo cadmio su tutta la superficie. Tutti questi tre taxa, secondo la sistematica proposta da Candusso (1997), appartengono alla sezione Coccineae, che contempla specie caratterizzate dalla trama imeniale irregolare a ife corte e subparallele, sottosezione Squamulosae che include specie con cappello solitamente asciutto, squamuloso-lacerato, specialmente al centro ed a epicute costituita da un tricoderma, gambo con superficie asciutta e liscia, concolore al cappello, lamelle da annesse ad adnate fino ad arcuato-decorrenti.
Fig 9. Hygrocybe coccineocrenata. Foto in habitat.
Fig 10. Hygrocybe coccineocrenata: a) spore; b) basidi; c) pileipellis; d) foto in habitat.
Simocybe laevigata (J. Favre) P.D. Orton, Notes from the Royal Botanical Garden Edinburgh 29 (1): 78 (1969)
Basionimo = Naucoria centunculus var. laevigata J. Favre, Bei- träge zur Kryptogamenflora der Schweiz 10 (3): 138 (1948)
Sinonimi = Simocybe centunculus var. laevigata (J. Favre) Senn Irlet, Mycologia Helvetica 7 (2): 47 (1995)
= Ramicola laevigata (J. Favre) Watling, Notes from the Royal Botanical Garden Edinburgh 45 (3): 555
(1989)
= Naucoria laevigata (J. Favre) Kühner & Romagn., Flore Analytique des Champignons Supérieurs: 236 (1953)
= Agrocybe laevigata (J. Favre) Romagn., Bulletin de la Société Mycologique de France 78 (4): 343 (1963)
Pileo 10-15 mm, sottile, fragile, da campanulato-convesso a rapidamente piano-convesso, nei giovani esemplari con umbone a forma di papilla che in seguito tende ad abbassarsi fino a scomparire del tutto negli esemplari spianati, orlo involuto, sinuoso, rivestimento pileico igrofano, glabro, liscio, lucente a tempo umido, di aspetto granuloso in particolare nella zona discale, nettamente striato radialmente per trasparenza fino al centro, dapprima di colore bruno-aranciato, poi pallidescente a macchie sui toni dell’ocra chiaro, infine uniformemente ocraceo pallido.
Lamelle smarginate, ventricose, spaziate, intercalate da 3 a 6 lamellule di diversa lunghezza, dapprima di colore crema-grigiastro, poi grigio-ocraceo, poi nettamente ocracee, con il filo biancastro, finemente crenulato.
Stipite 20-40 x 2-3 mm, cilindrico, da regolare a leggermente sinuoso, fistoloso, assottigliato alla base, fragile, sottile, liscio, di aspetto vitreo, fibrilloso longitudinalmente, striato all’apice per la decorrenza delle lamelle dove si presenta inoltre pruinoso, di colore dapprima bianco-grigiastro, in seguito grigio-ocra.
Carne molto sottile, fragile, inodore e insapore.
Spore (6,9)7,3- 8,4(8,7) x (4,4)4,5-5,1(5,3) μm, in media 7,9 x 4,8 μm, Q. = 1,4-1,8, Q.m. = 1,6, Vol.m. 98,5 μm³, ellissoidali viste di faccia, da faseoliformi a subamigdaliformi viste di profilo, lisce, con una o numerose guttule lipidiche, apiculo poco evidente, parete spessa 0,5-0,8 μm, giallastre in acqua, prive di evidente poro germinativo, occasionalmente con breve callus.
Basidi 20,0-26,0 x 6,0-8,0 μm, in media 22,5-7,0 μm, tetrasporici, in diversi casi bisporici, con giunto a fibbia basale, ialini.
Cheilocistidi 29,5-45,0 x 5,0-9,0 μm, in media 38,0 x 7,0 μm, apice largo 6,0-11,0 μm, in media 7,5 μm, polimorfi, da cilindrici a leggermente clavati, sinuosetti, saltuariamente strettamente utriformi, in alcuni casi sublageniformi, a parete sottile, ialini. Pleurocistidi non osservati.
Caulocistidi 26,5-42,5 x 4-5,5 μm, in media 34,5 x 4,5 μm, apice largo 8,0-9,5 μm, in media 9,0 μm, cilindrico/clavati, da molto scarsi a rarefatti, osservati solo all’apice dello stipite, assenti più in basso.
Pileipellis costituita da un imeniderma di cellule da strettamente a largamente clavate fino a vesiculoso/pedicellate, a parete sottile e fortemente incrostata da un pigmento bruno, di dimensioni 19,5-54,5 x 8,5-22,5 μm, in media 32,5 x 13,0 μm. Ife oleifere assenti.
Giunti a fibbia presenti.
Materiale studiato
Italia. F.V.G. Udine. Comune: Paularo. Località: Cason di Lanza. Coordinate geografiche: 46º34’23’’ N 13º10’08’’ E. Altezza 1707 m s.l.m. Raccolte: 03.09.2011 (n° 5218). Legit. P. Picciola; det. M. Zugna & P. Picciola.
Fig 11. Simocybe laevigata. Foto in habitat.
Fig 12. Simocybe laevigata: a) pileipellis; b) caulopellis; c) cheilocistidi; d) spore.
Fig 13. Foto a confronto: da sin 1-3-5-6 Galerina paludosa; 2-4 Galerina tibiicystis.
Fig 14. Foto a confronto: da sin 1-3-6-7 Hypholoma elongatum; 2-4-5 Galerina. paludosa.
Ringraziamenti
Un sentito grazie a Marco Floriani - Pergine (TN), per l’invio di bibliografia.
Bibliografia citata nel testo
Campo E. - 2007: La “torbiera alta” ed i suoi funghi.
Bollettino del Centro Micologico Friulano. 12-16.
Candusso M. - 1997: Hygrophorus s.l. Fungi Euro- paei. Candusso. Alassio.
Curti M. & E. Musumeci - 2005: Appunti sul ge- nere Galerina. Osservazioni su alcuni taxa dell’Eu- ropa centro-meridionale. Boll. Gruppo Micologico
G. Bresadola - Nuova Serie. BGMB. 48 (3): 5-62. Eyssartier G. & P. Roux - 2011: Le guide des cham- pignons France et Europe. Éditions Belin.
Favre J. - 1948: Beiträge zur Kryptogamenflora der Schweiz, 10 (3):138.
Horak E. & A. Ronikier - 2011: Simocybe montana (Crepidotaceae, Agaricales), a new species from the alpine belt in the Swuiss Alps and rhe Romanian Carpathians. Mycol Progress (10):439-443.
Kühner R. & H. Romagnesi - 1953: Flore Analyti- que des Champignons Supérieurs. Masson. Paris. Lonati G. - 1989.
Funghi rari o poco conosciuti. Boll. dell’Associazione Micologica Ecologica Roma- na (43): 3-12.
Moser M. - 1980: Guida alla determinazione dei funghi. Vol. 1. Polyporales, Boletales, Agaricales, Russulales. Saturnia. Trento.
Minelli A. (a cura di) - 2004: Le torbiere montane - Relitti di biodiversità in acque acide. Quaderni Habitat. Ministero dell’Ambiente e della Tutela del Territorio e Museo Friulano di Storia Naturale - Comune di Udine.
Moreau P.A. - 1992. Analyse ècologique et patrimo- niale des champignons supèrieurs dans les torbières des Alpes du Nord. These. C.I,S.M. Universitè de Savoie.
Noordeloos M.E. - 2011: Strophariaceae s.l. Fungi Europaei n°13. Ed. Candusso. Italia.
Orton P.D. - 1969: Notes from the Royal Botanical Garden Edinburgh 29 (1): 78.
Padovan F., L. Lorenzon, E. Campo, M. Floriani,
L. Michelin, R. Brotzu, E. Bizio & M. Magnozzi - 2020: 1260 Funghi della Provincia di Belluno. At- lante Fotografico. Associazione Micologica Bresadola - Gruppo di Belluno.
Redhead, S. A. 1981. Parasitism of bryophytes by agarics. Can. J. Bot. 59: 63-67
Reid D.A. - 1984: A revision of the British species of Naucoria sensu lato. Trans. Br. Mycol. Soc. 82(2): 191-237.
Romagnesi H. - 1963: Bulletin de la Société Myco- logique de France 78 (4): 343.
Senn-Irlet B. - 2012: Simocybe P. Karst. In: Funga Nordica - Agaricoid, boletoid and cyphelloid genera (eds. Knudsen H. & J. Vesterholt)
Smith A.H. & R. Singer -1964: A monograph on the genus Galerina Earle. Hafner Publishing Company. New York.
Vellinga E.C. - 1988: Glossary. In: Flora Agaricina Neerlandica 1: 54-64 (eds. Bas C., TH.W. Kuyper, M.E. Noordeloos & E.C. Vellinga), Balkema, Rot- terdam.
Watling R. - 1989: Notes from the Royal Botanical Garden Edinburgh 45 (3): 555
Bibliografia consultata
Breitenbach J. & F. Kränzlin - 2000: Champignons à lames 3ème partie. Champignons de Suisse. T.5. Mycologia. Lucerna.
Campo E. - 2000: La torbiera e i suoi funghi. I funghi dove … quando. (70): 12-19.
Campo E. - 2015: Hygrophorus, Hygrocybe e Cupho- phyllus del Friuli Venezia Giulia. Gruppo Micolo- gico Sacilese.
Candusso M. - 1997: Hygrophorus s.l. Fungi Eu- ropaei. Candusso. Alassio.
Papetti C. - 1998: Alcune Hygrophoraceae interessanti dell’arco alpino e prealpino. Rivista di Micologia. (1):3-24.
Vašutová M., D. Dvorak & M. Beran - 2013: Rare macromycetes from raised bogs in the Hruby Jeseník Mts. (Czech Republic). Czech Mycology 65(1): 45-67.