Osservazioni su raccolte giuliane di due interessanti specie di Callistosporium
di Paolo Picciola* e Marino Zugna**
(*) Paolo Picciola – Via D’Alviano, 86 – 34144, Trieste – e-mail: paolo.picciola@libero.it
(**) Marino Zugna – Località Rio Storto, 7 – 34015, Muggia (TS) – e-mail: marinozugna@fastwebnet.it
RIASSUNTO
Gli autori riportano delle dettagliate descrizioni di Callistosporium olivascens e Callistosporium luteo-olivaceum desunte da alcune raccolte effettuate nei comuni di Trieste e Muggia (Friuli Venezia Giulia - Italia).
Per entrambe le specie sono fornite le caratteristiche macro-, microscopiche, corredate dalle diagnosi originali, nonché da fotocolor dei basidiomi in habitat e dei principali elementi microanatomici investigati.
Il presente contributo include una breve rassegna sulla sistematica del genere Callistosporium, con particolare riguardo alle specie europee, un’analisi sulla variabilità di alcuni elementi microanatomici e sui pigmenti che caratterizzano tale genere. Il lavoro si conclude con alcune note riguardanti l’ecologia e la distribuzione geografica in Italia delle specie trattate.
Introduzione
Il genere Callistosporium è stato creato da SINGER (1944) per accogliere delle specie saprotrofe, di piccola taglia, con portamento collybioide, a sporata bianca e con abbondanti pigmenti intracellulari nelle spore e in alcuni casi nei basidi specialmente se osservati in ammoniaca.
In un contributo successivo, lo stesso autore (1970) precisa che i Callistosporium si caratterizzano per la presenza, nelle strutture imeniali, di abbondanti necropigmenti che si manifestano, con la disidratazione, sotto forma di pigmenti più o meno brillanti.
In relazione alle diverse specie tali pigmenti possono essere: porpora, viola, rosso, giallo oro, verde, etc.
Sempre secondo SINGER (1977), Callistosporium è un genere che annovera 10 specie: C. favrei Sing., C. palmarum (Murr.) Sing.,C. galerinoides Sing., C. chrysophorum Sing., C. heimii (Sing.) Sing., C. luteofuscum Sing., C. amazonicum Sing., C. terrigenum Sing., C. luteo-olivaceum (Berk. & Cur.) Sing., C. majus Sing..
Nel 1986, egli introduce altre tre specie: C. xanthophyllum (Malençon & Bertault) Bon, C. xerampelinum (Pegler) e C. graminicolor Lennox.
Attualmente, il genere Callistosporium comprende a livello mondiale 13-16 taxa (Index Fungorum e MykoBank), gran parte dei quali provengono da zone tropicali e subtropicali dell’Asia e delle Americhe, soltanto un numero ridotto di essi cresce nella fascia boreale dell’Eurasia e del Nord America.
Tale genere possiede i seguenti caratteri: dimensioni da piccole a medie; portamento collybioide; cappello igrofano oppure no, liscio o feltrato, con colori molto intensi e variegati, quali giallo, giallo-verdastro, olivastro, rossastro, porpora-rossastro; lamelle generalmente concolori al pileo, da fitte a spaziate; gambo liscio o fibrilloso, fistoloso, subcartilagineo; carne esigua, inodora o aromatica, insapora o più o meno sgradevole; sporata bianca o crema chiaro; nell’imenio e nella pileipellis presenti dei pigmenti di natura perlopiù antrachinonica di colore giallo oro, porpora, viola, rosso; spore lisce, inamiloidi, ialine, largamente ellissoidali, subcilindriche, allantoidi, amigdaliformi; basidi non carminofili, talvolta piuttosto lunghi (igroforoidi) , mono-bi-tri-tetrasporici; cistidi veri e propri assenti, presenti elementi basidioliformi (pseudocheilocistidi); assenza di giunti a fibbia in tutti i tessuti; pileipellis tipo cutis o subtricodermica, con tre pigmenti (intracellulare, parietale, epimembranario); crescita saprotrofa su tronchi e ceppaie in disfacimento di latifoglia e conifera o su detriti vegetali a terra in decomposizione.
I Callistosporium europei
La conoscenza sui Callistosporium europei si fonda principalmente sui contributi di BON (1976, 1990, 1991), MALENÇON & BERTAULT (1975), SINGER (1977, 1986) e MOSER (1986, b).
BON (1976) contempla sul suolo europeo le seguenti specie e una varietà: C. majus Sing., C. elaeodes (Romagn.) Bon, C. olivascens (Boud.) Bon e C. olivascens var. aerinum (Quél.) Bon; in seguito lo stesso BON (1990) istituisce C. olivascens var. donadinii Bon.
Egli, inoltre, nel 1991, proponendo delle nuove ricombinazioni e sinonimie include le seguenti specie: C. olivascens (Boud.) Bon con le due varietà aerinum e donadinii, trasferisce Collybia xanthophylla Malençon & Bertault nel genere Callistosporium Sing. ponendola in sinonimia con C. majus Sing., conferma C. elaeodes (Romagn.) Bon come entità autonoma, infine include C. favrei Sing.
MOSER (1978), invece, riporta per l’Europa soltanto tre specie: C. olivascens (Boud.) Bon, C. elaeodes (Romagn.) Bon e C. xanthophyllum (Malençon & Bertault) Bon, quest’ultimo ritenuto, come proposto da BON, conspecifico di C. majus Sing.
In seguito, lo stesso MOSER (1986b), sostenendo la tesi di REDHEAD (1982, vedi infra), sinonimizza C. xanthophyllum con la specie americana Callistosporium luteo-olivaceum (Berk. & M.A. Curtis) Sing. e riporta per l’Europa C. elaeodes Bon, C. favrei Sing. e C. olivascens (Boud.) Bon.
Da un punto di vista sistematico, il taxon Callistosporium è stato incluso nella famiglia delle Tricholomataceae (Fayod) R. Heim ex Pouzar (SINGER, 1944, 1970, 1986; BON, 1976, 1991; MOSER, 1986; BAS, 1996; BOCCARDO et al., 2013).
Singer (1970) lo colloca nella subtribù delle Omphalinae Singer della tribù Tricholomataceae-Clitocybeae, a fianco dei generi Armillariella (P. Karst.)P. Karst., Arthrosporella Sing., Lulesia Sing., Omphalina Quél., Gerronema Sing., Pleurocollybia Sing., Lactocollybia Sing., Macrocystidia Joss. e Podabrella Sing.
BON (1990, 1991), invece, considerando i basidi igroforoidi che caratterizzano il sottogenere Xerophorus Bon (complesso C. olivascens), ipotizza per questo sottogenere una sua diversa collocazione sistematica, in una posizione intermedia tra le Tricholomataceae (Fayod) R. Heim ex Pouzar e le Hygrophoraceae Lotsy.
Più recentemente BOCCARDO et al. (2013) adottando una sistematica basata su studi di analisi molecolare (MATHENY et al., 2006) inserisce il genere Callistosporium nel Catathelasma clade appartenente al clade Tricolomatoide che include i generi Catathelasma Loveiov, Pseudoclitocybe (Sing.) Sing. e Ripartites Karst.
In un contributo successivo SÁNCHEZ-GARZÍA et al. (2014) situa il Catathelasma clade tra le Entolomataceae e le Lyophyllaceae.
Un contributo ancora più recente (LAVORATO, VIZZINI, GE & CONTU, 2015) ha invece dimostrato che tale genere ricade nel Callistosporioid clade risultando sister groups dei generi Pseudolaccaria Vizzini, Contu & Z.W. Ge, Macrocybe Pegler & Lodge, Pleurocollybia Singer e Clitocybe aff. fellea.
Per quanto concerne la sistematica infragenerica dei Callistosporium, BON (1976) ha inizialmente inserito tutte le specie europee nel sottogenere Pseudocollybia Kühner ex Bon, caratterizzandolo per i colori più o meno olivacei e per i basidi con necropigmento che in ammoniaca diventa rosso-arancio o rosso-porpora.
Nelle proposte sistematiche successive dello stesso autore (1990, 1991), il genere Callistosporium Sing. è stato suddiviso in due gruppi ben distinti: il sottogenere Xerophorus Bon (1990) [= Sez. Olivascentia (Bon & Perco, in Perco 1988)], che comprende specie a lamelle spaziate, spore superiori a 8 µm, basidi slanciati (igroforoidi) che raggiungono i 50 (55) µm di lunghezza, a cui appartiene il complesso C. olivascens e il sottogenere Callistosporium Bon (1991) che accoglie specie a lamelle fitte, spore generalmente inferiori a 8 µm, basidi non igroforoidi, a cui appartengono le specie e sue varietà che gravitano attorno a C. xanthophyllum (= C. luteo-olivaceum).
Questa suddivisione infragenerica è ripresa e confermata da MOSER (1986b).
Materiali e metodi
La descrizione dei caratteri macroscopici è stata desunta analizzando i basidiomi freschi fotografati in habitat mediante fotocamera digitale Nikon D90. Lo studio dei caratteri microscopici è stato eseguito sia sul fresco che su materiale d’erbario, quest’ultimo è stato preventivamente reidratato in acqua distillata o una soluzione acquosa di idrossido di potassio (KOH) al 5%, ed ove necessario colorato con Rosso Congo Ammoniacale 2% per meglio evidenziare le differenti tipologie cellulari.
Per l’osservazione dei pigmenti sono stati immersi dei frammenti sia di materiale fresco che di exsiccatum in acqua e successivamente in ammoniaca (NH4OH) al 3% e al 25% e idrossido di potassio (KOH) 5% per alcuni minuti. Le foto concernenti la microscopia sono state eseguite con l’ausilio di una fotocamera Reflex Canon EOS 50D, posto sul terzo occhio del trinoculare di un microscopio biologico Optech Biostar B5, supportato da ottiche Plan-APO, illuminazione alogena 12V-50 W a luce riflessa con regolatore d'intensità.
Le misure microscopiche sono state eseguite con il software di calcolo Mycométre gentilmente fornitoci dal sig. Georges Fannechère e prelevabile all’indirizzo http://mycolim.free.fr. Le misure sporali sono state rilevate solamente da spore in proiezione laterale, con l’apiculo e i contorni a fuoco, provenienti dall’imenio tenendo conto di tutte le spore visualizzate nel campo visivo.
Per la terminologia riguardante la tipologia delle caratteristiche macro e microscopiche si fa riferimento a VELLINGA (1988).
Per quanto concerne la nomenclatura delle specie presentate si è fatto riferimento alle indicazioni contenute nei siti http://www.indexfungorum.org/ e http://www.mycobank.org. Gli exsiccata sono depositati nell'erbario del gruppo micologico A.M.B. di Muggia e del Carso.
Per poter definire il campo di variabilità di alcuni caratteri macro e microscopici delle specie trattate sono stati effettuati dei rilievi su più raccolte crescenti negli stessi siti di crescita: una aiuola a Cedrus per C. olivascens e una ceppaia di Pinus nigra per C. luteo-olivaceum.
Tassonomia
Etimologia: dal latino “Callistospòrium” = “dalle spore bellissime” in relazione alla presenza di pigmenti intracellulari giallo oro.
Specie tipo: Callistosporium palmarum (Murrill) Singer, Mycologia 36: 363 (1944) [provenienza Florida (USA)] (basionimo Gymnopus palmarum Murrill).
Diagnosi originale del Genere Callistosporium in Singer, Mycologia 36: 363 (1944)
Tricholomatacearum genus; pileo hygrophano vel sicco, cuticula ex hyphis repentibus composita; carne tenui; hymenophoro lamelloso, lamellis angustato-adnexis, vel adnatis, vel emarginatis; sporis ellipsoideis, levibus, permultis pigmenti corpusculo purpureo vel atrolilacino aut pigmenti solutione rubro-rosea vel lilacina impeti, membrana inamyloidea, tenui, hyalina instructis; pleurocystidiis nullis; tramate lamellarum regulari, haud amiloideo; stipite centrali, subcartilagineo, tenui; hyphis omnibus fibulis destitutis. Habitatio: Ad basin palmarum et ad ligna.
Callistosporium olivascens (Boud.) Bon
Documents Mycologiques 6 (22-23): 283 (1976)
Basionimo: Tricholoma olivascens Boud., Bulletin de la Société Mycologique de France 33: 7 (1917)
Sinonimi: Collybia aerina Quél., Comptes Rendus de l´Association Française pour l´Avancement des Sciences 12: 498 (1884)
Callistosporium olivascens var. aerinum (Quél.) Bon, Documents Mycologiques 6 (22-23): 286 (1976)
Callistosporium olivascens var. donadinii Bon, Documents Mycologiques 20 (79): 57 (1990)
Callistosporium donadinii (Bon) Contu, Micologia Italiana 22 (1): 55 (1993)
Etimologia: dal latino “olivascens” per il colore olivastro dei basidiomi.
Diagnosi originale
Minus, 2,5-3,5 cm. latum, totidem altum, fuligineo-virens, centro margineque ochraceum; pileo convexo, subumbonato, glabro sed margine elevato subpulverulento, pallidiore et cum umbone ochraceis; lamellis pallidis, sordide ochraceis; sinuate, sat distantibus et subcrassis; carne sordide ochracea; stipite cavo, cylindrico, ochraceo, fibrilloso, fibrillis olivaceis, ad basim albo; basidiis 4-sporis, 20 x 5; sporis ovatis, hyalinis, intns normaliter 1-guttulatis, aliquoties granulosis, levibus, 9-10 x 5-7; odore debili. Hab. Ad terram. Hyères, Gallia (D. KOENIG) – Ad genus Hygrophorum vergens.
Portamento collybioide, di piccola taglia.
Modalità di crescita a piccoli gruppi, raramente subcespitosi, con 3-4 esemplari ravvicinati.
Pileo fino a 42 mm di diametro, sottile, dapprima convesso, con eventuale accenno d’umbone, progressivamente disteso, infine con tenue depressione discale, margine involuto, da sinuoso a lobato, sottile, non striato per trasparenza, un po’ eccedente, superficie igrofana, asciutta, un po’ tomentosa-feltrata, raramente pruinosa, in alcuni casi zonata in prossimità del margine, a tempo umido bruno-rossastra, mattone rugginoso, più pallida al margine, a tempo asciutto grigio-ocracea, pruinosa; cuticola non asportabile o tutt’al più solo per brevissimo tratto al margine.
Lamelle da smarginate a brevemente decorrenti con dentino, piuttosto spaziate, spesse, sinuose, un po’ ceracee al tocco, ventricose, larghe fino a 5 mm, con seni trasversali sul fondo, filo intero, concolore, più o meno ondulato, intercalate da 2-5 lamellule di diversa lunghezza, di colore giallastro, giallo-olivastro, con sfumature ocra-olivastre, grigio-olivastre.
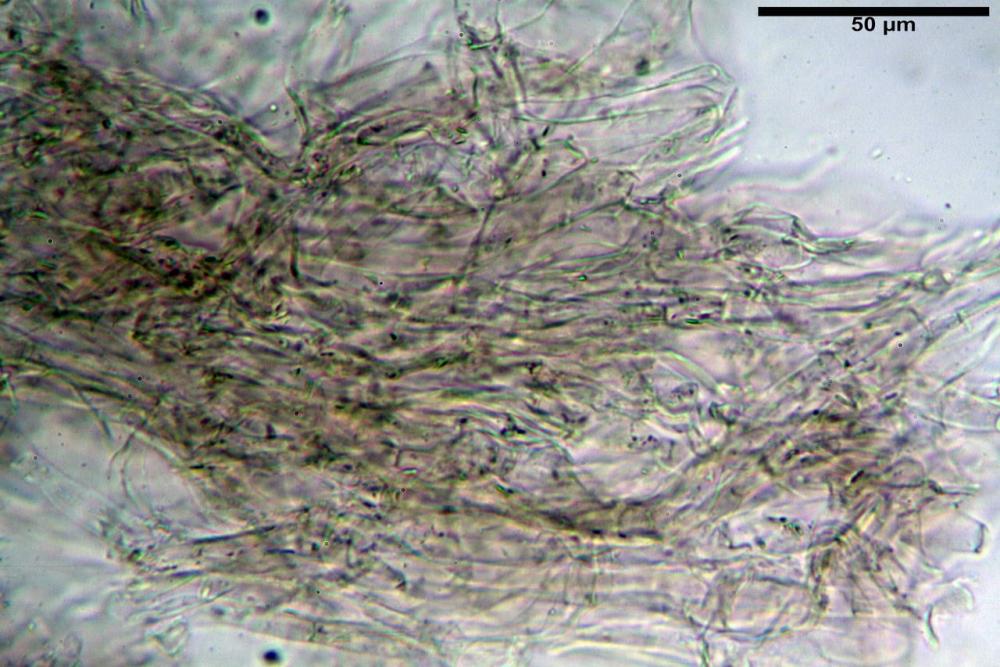
Stipite 18-55 x 3-9 mm, elastico, cilindrico-schiacciato, obconico, sovente eccentrico, da sinuoso a tortile, incurvato, con base attenuata, raramente ingrossata, fistoloso, infine cavo, superficie fibrillosa, asciutta, dapprima ricoperta da una feltratura biancastra su tutta la lunghezza che con lo sviluppo tende a scomparire facendo intravvedere la colorazione ocracea del fondo, base terminante con numerose rizomorfe bianche che inglobano abbondanti residui terrosi del substrato.
Carne esigua, tenera nel cappello, fibrosa-elastica nel gambo, a tempo umido brunastra e acquosa nel cappello e nella corteccia dello stipite, crema-giallastra al centro, con tendenza ad impallidire con l’asciutto, odore da debole a distintamente rancido specie se contuso o stropicciato sulle lamelle, sapore leggermente amarescente.
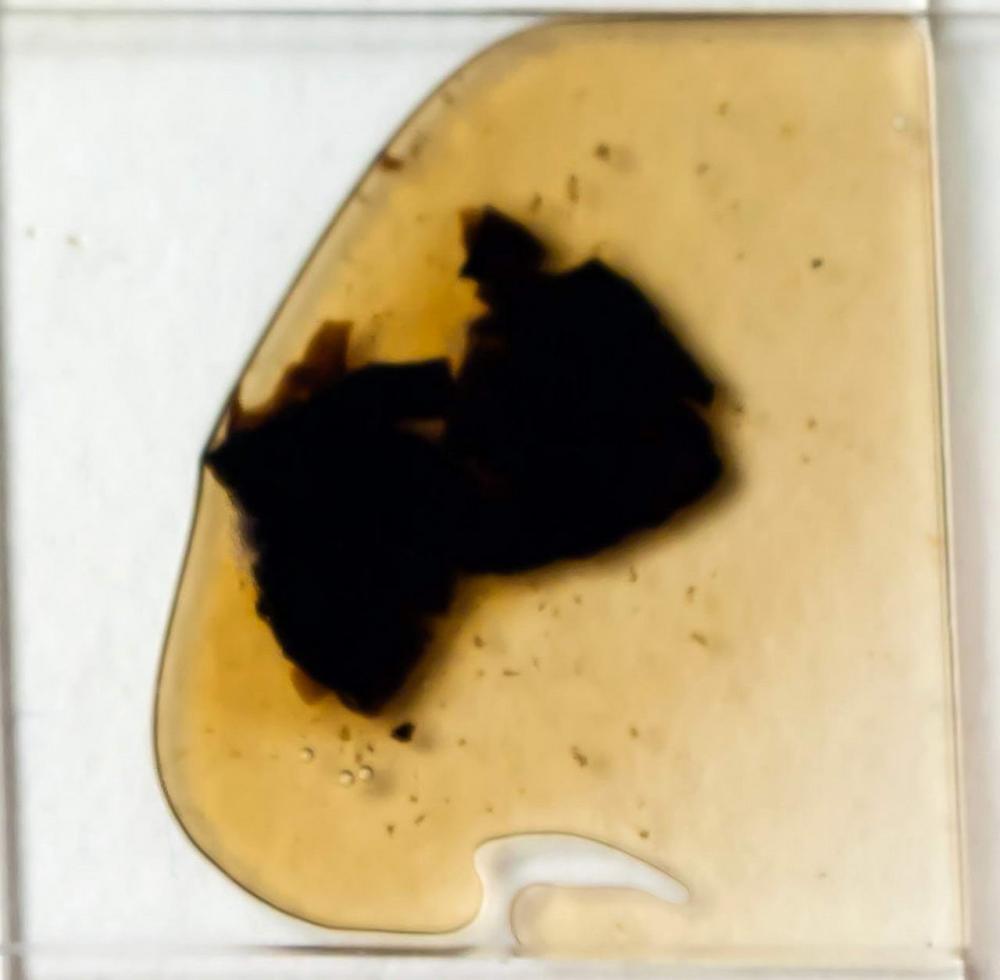
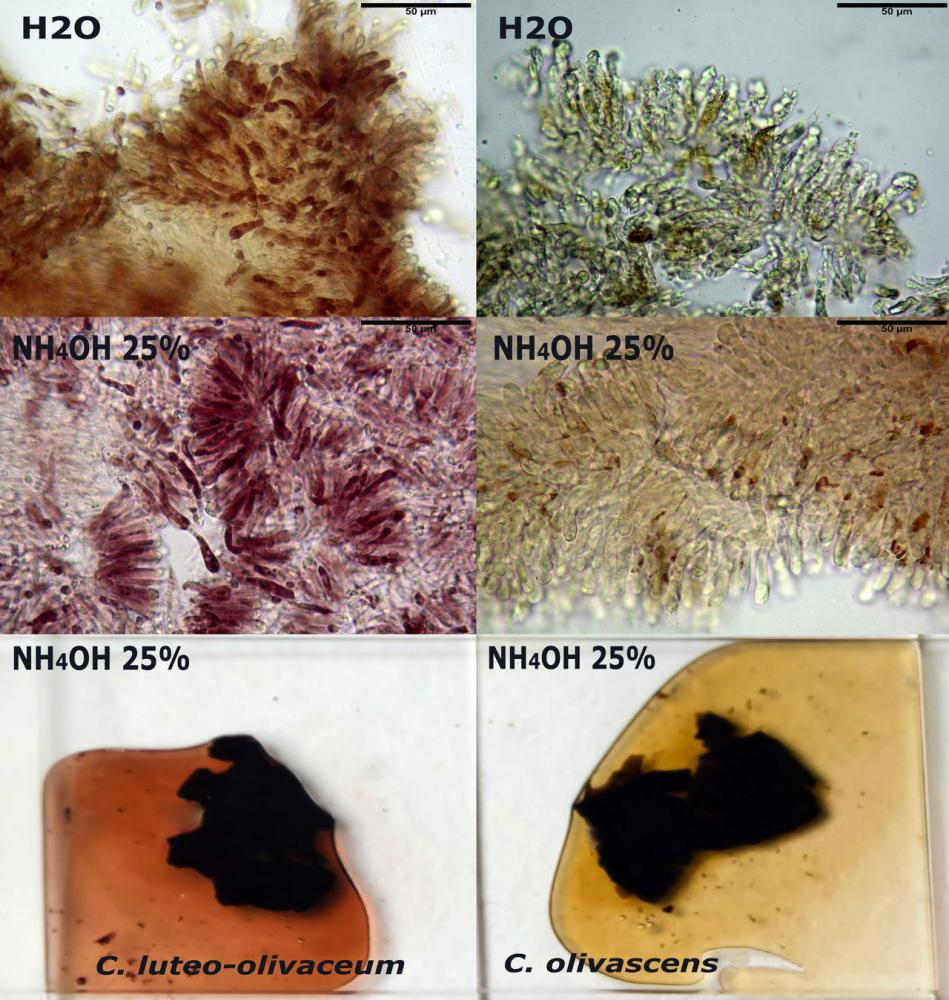
Macroreazioni su basidiomi freschi l’intero carpoforo si colora rapidamente di verde-bluastro a contatto con le basi (ammoniaca 3% e idrato di potassio 5%) (vedi foto), su materiale d’erbario, invece, preventivamente idratato con acqua e successivamente immerso in ammoniaca al 25% si osserva che questa si colora di giallo-verdastro (vedi foto).
Sporata bianca, reazione nulla con le basi.
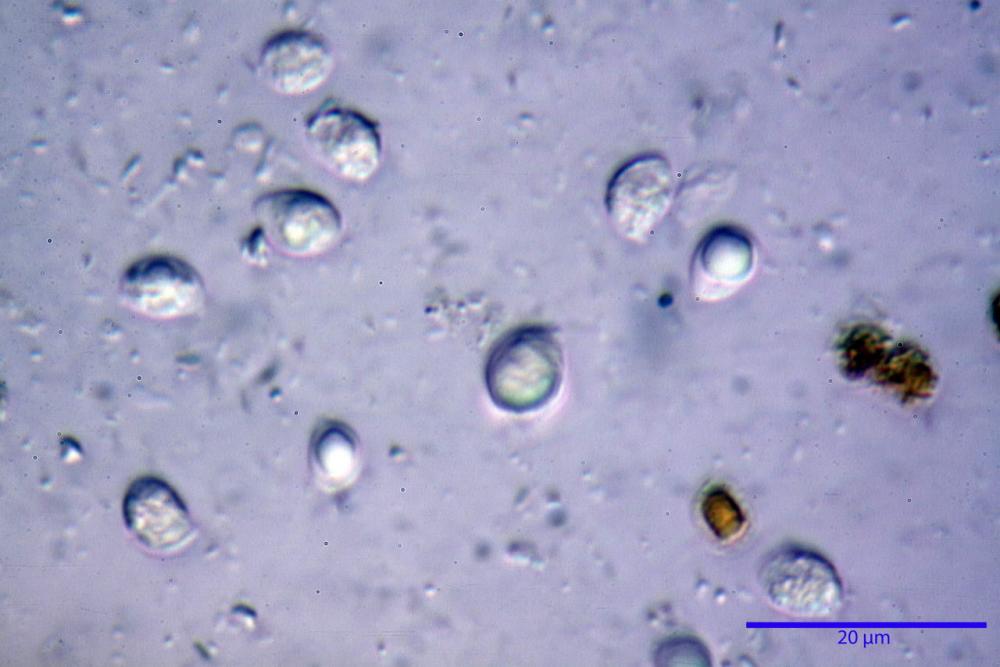
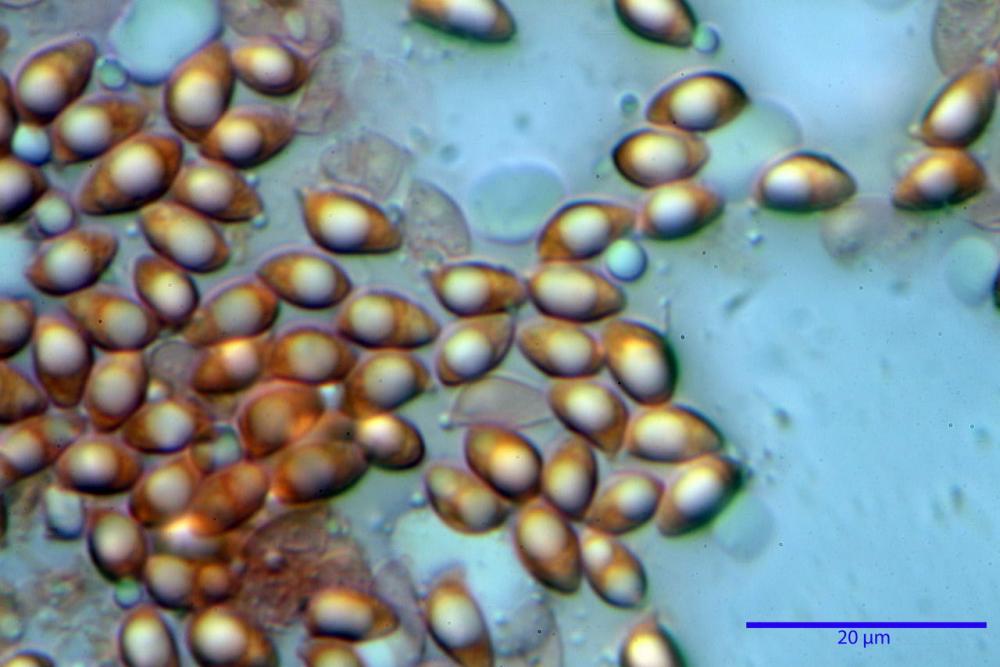
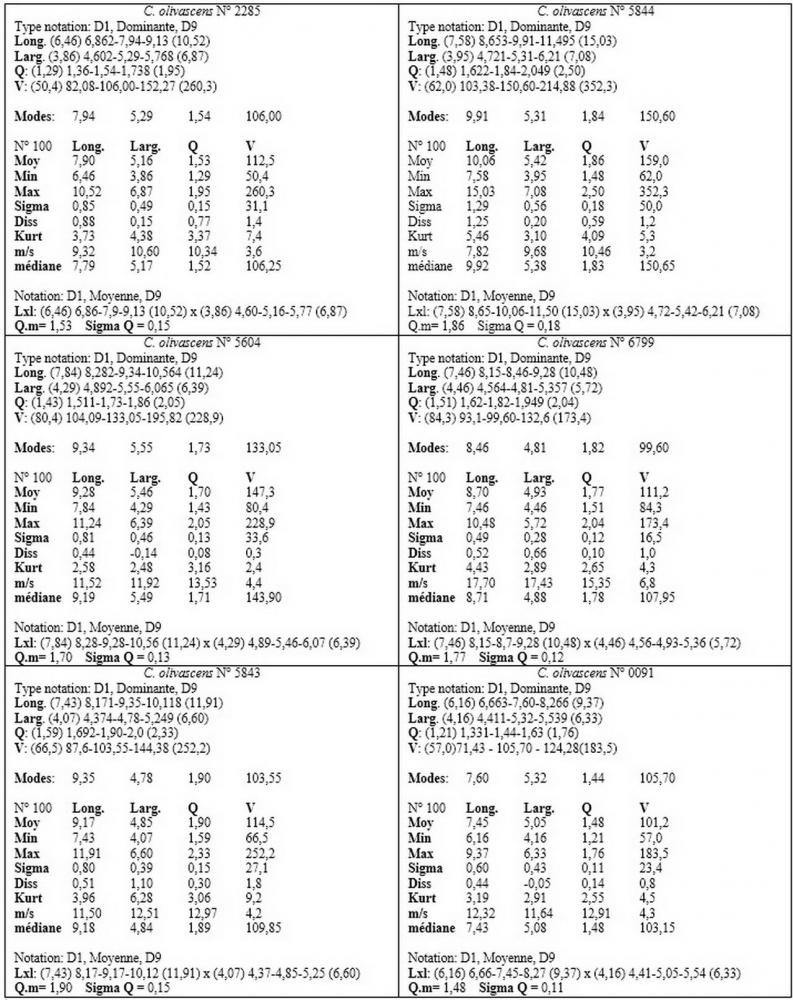
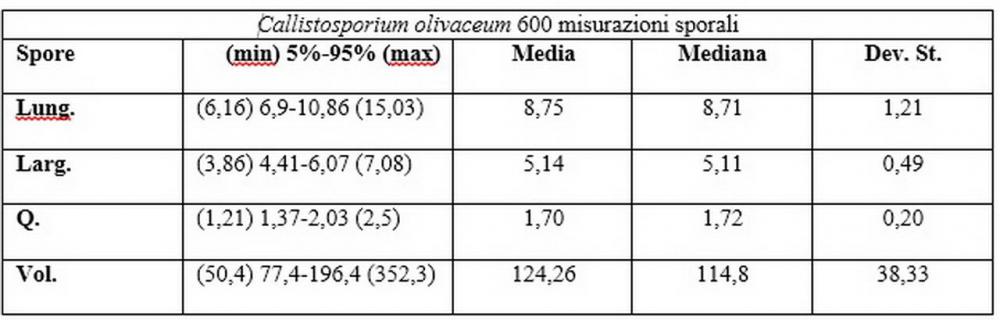
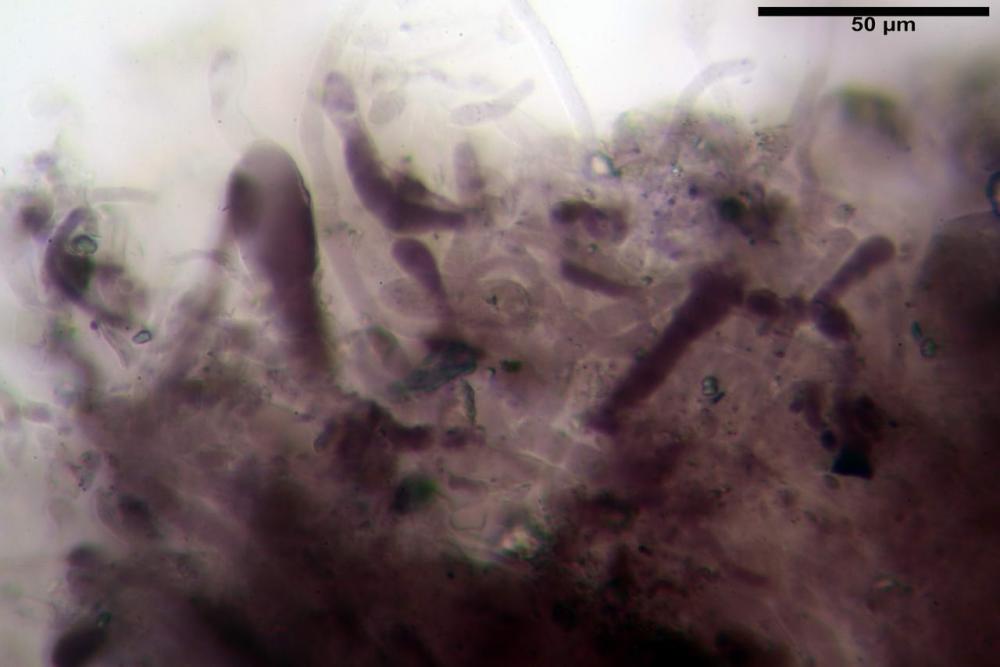
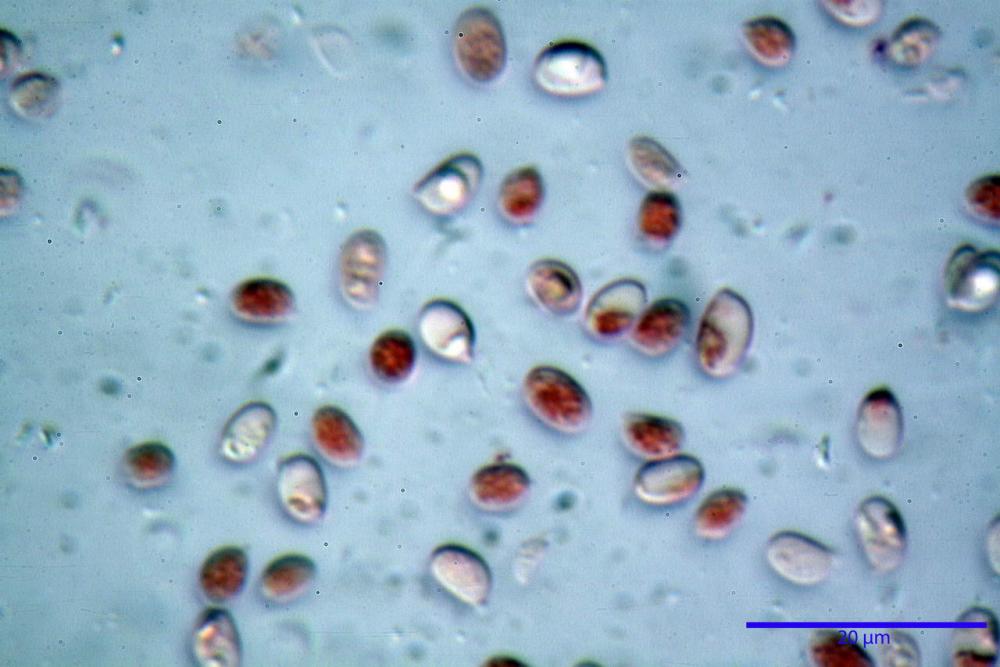
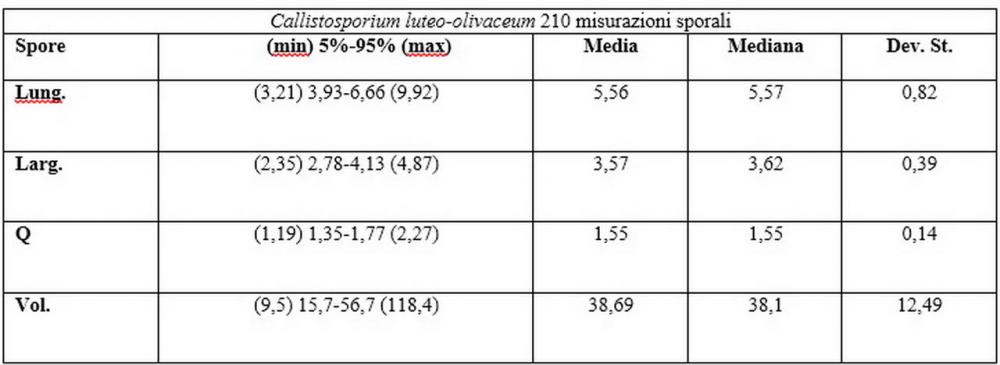
Spore (6,16) 6,9-10,86 (15,03) x (3,86) 4,41-6,07 (7,08) µm, in media 8,75 x 5,14 µm, Q. = (1,21) 1,37-2,03 (2,5), Q.m. = 1,70, Vol. = (50,4) 77,4-196,4 (352,3) µm³, Vol.m =124,26 µm³, (n =600, sei raccolte), in proiezione laterale amigdaliformi con accentuata depressione adassiale e apice ogivale; in proiezione frontale ellissoidali e apice arrotondato, a parete sottile, apiculo ben evidente, ialine, inamiloidi, con grande goccia oleosa collocata al centro, di colore grigio-verdastro, raramente con due, trattate con ammonio idrato 3% la guttula si colora più intensamente di verdastro, su campioni d’erbario osservati in ammoniaca 25% tale pigmento è ancor più evidente.
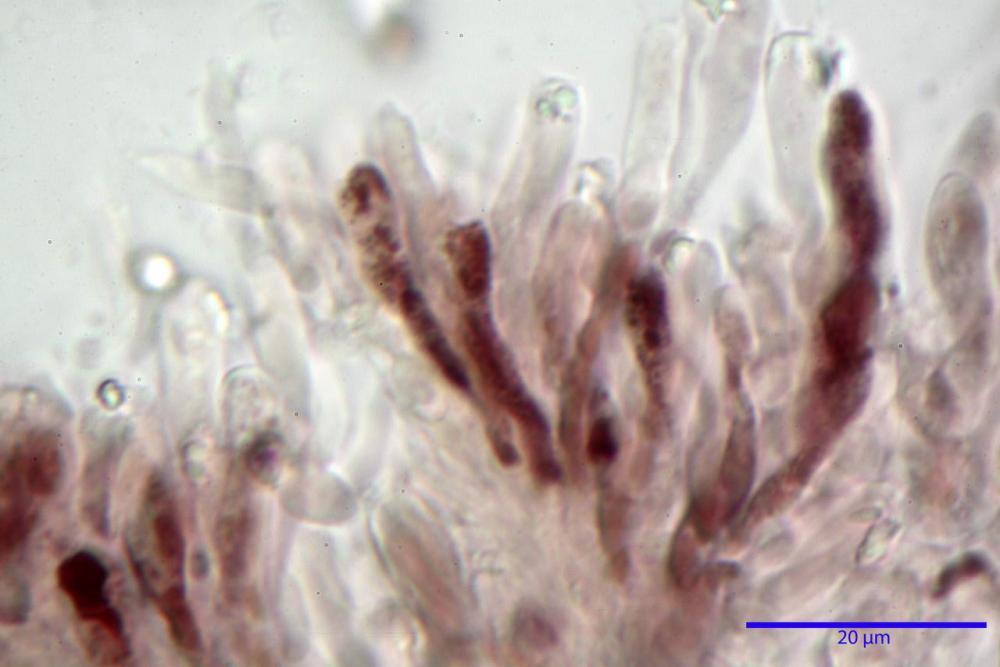
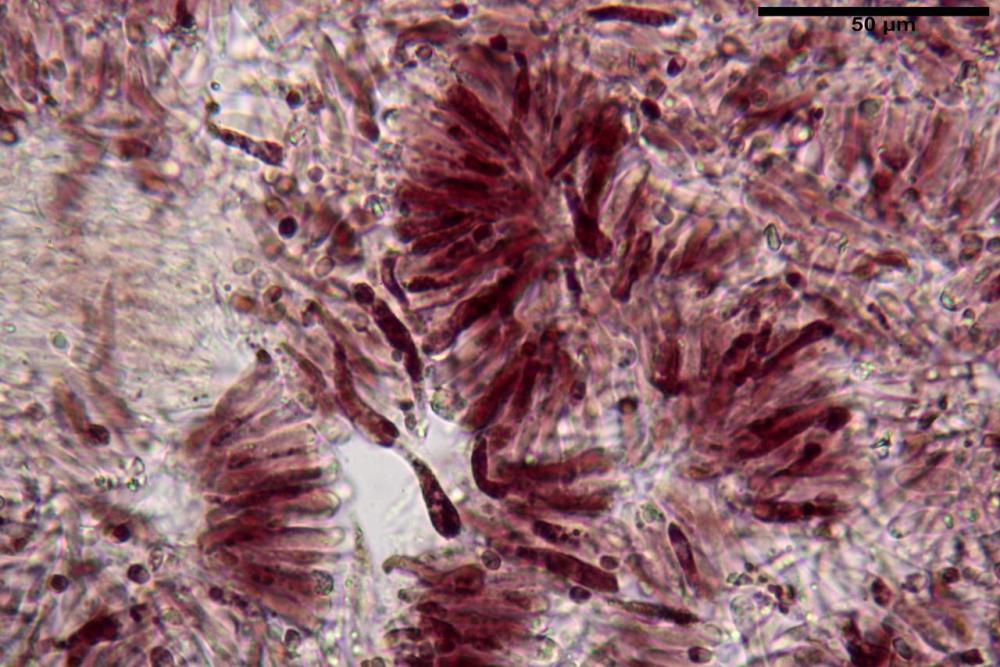
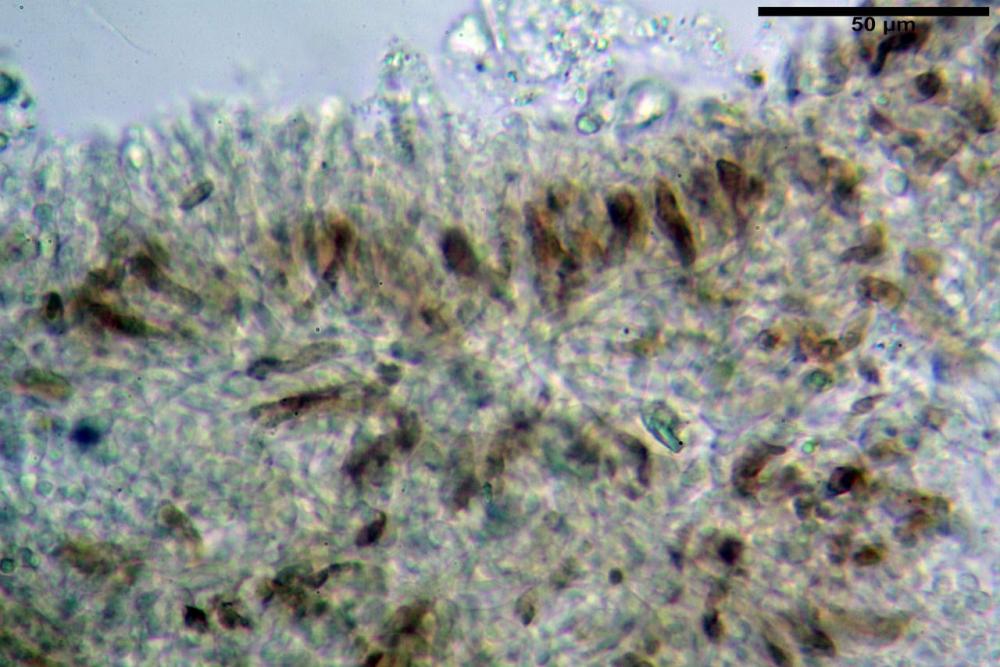
Basidi 32,4-57 (62) x 7,4-11 µm, Vol.m = 1189 µm³, strettamente claviformi, a parete da sottile a leggermente spessa, da poco a nettamente slanciati, mono-bi-tri-tetrasporici. In base alle raccolte possono prevalere quelli tetrasporici sui bisporici, oppure viceversa, quelli monosporici, molto più rari, possiedono sterigmi lunghi fino a 17 µm e larghi alla base fino a 3 µm; gli sterigmi rilevati nelle altre tipologie di basidi misurano 5-12 µm di lunghezza. Nei campioni freschi osservati in acqua è presente all’interno un pigmento granuliforme di colore verdastro che invade anche gli sterigmi, le guttule sono ialine. Nei secchi, invece, l’interno dei basidi appare ialino mentre le guttule assumono una colorazione verdastra, in ammoniaca 3% e idrato di potassio 5% i pigmenti inclusi nelle guttule divengono nettamente verdastri.
Basidioli 30-43 x 9-10 µm, numerosi, claviformi, simili ai basidi, presentano lo stesso contenuto osservato nei basidi.
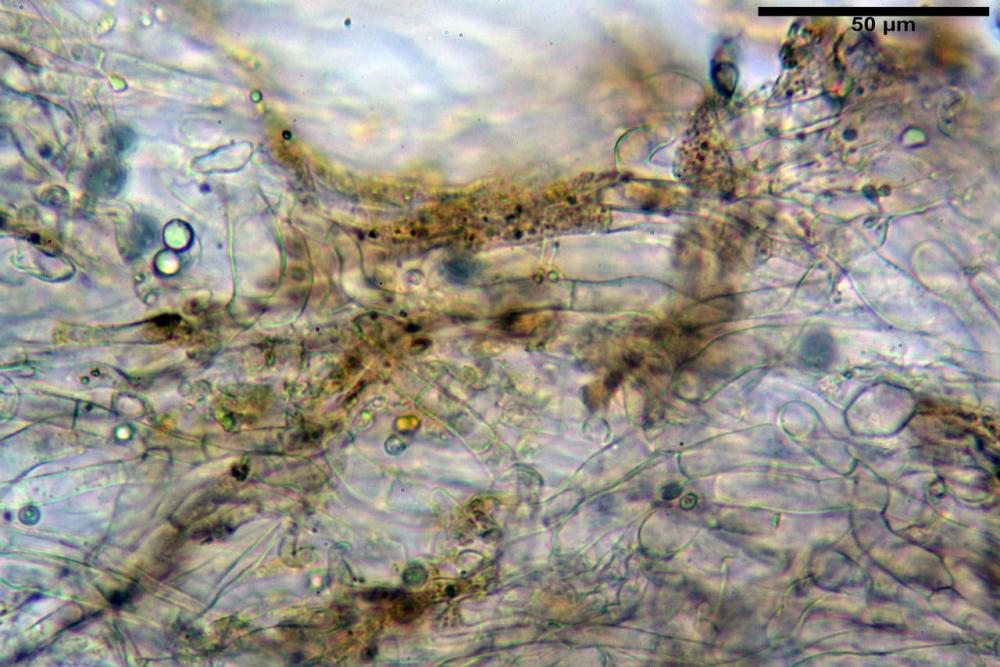
Subimenio composto da ife appressate, confusamente intrecciate, ialine, a parete sottile, larghe 3-5 µm, alcuni elementi ifali emergono dalla palizzata imeniale.
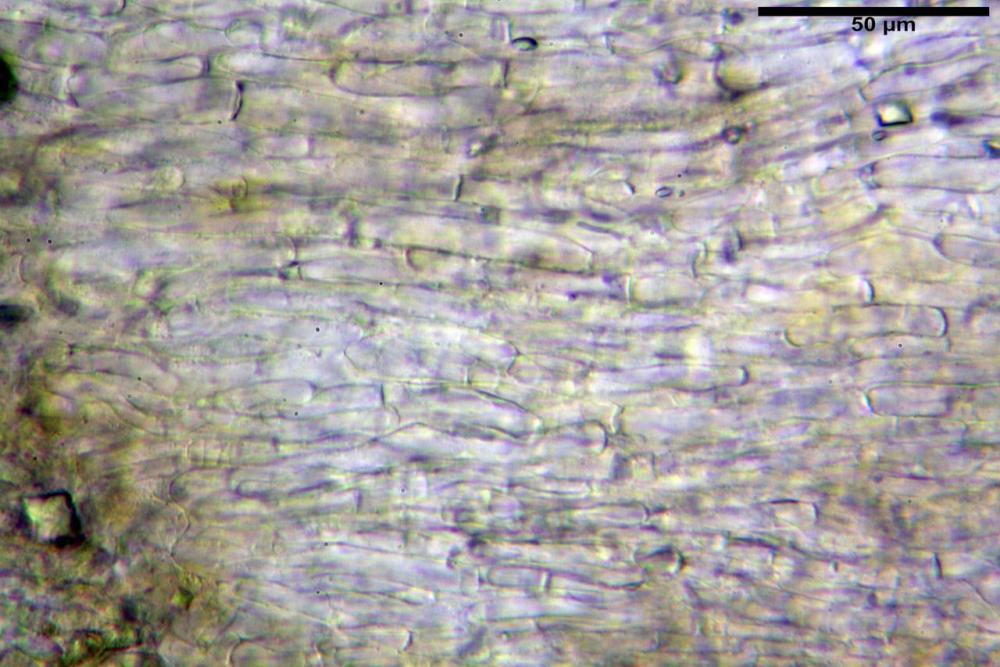
Trama lamellare parallela, formata da ife cilindriche, a parete sottile, ialine, attenuate ai setti, larghe 10-20 (22) µm, lunghe 35-160 µm.
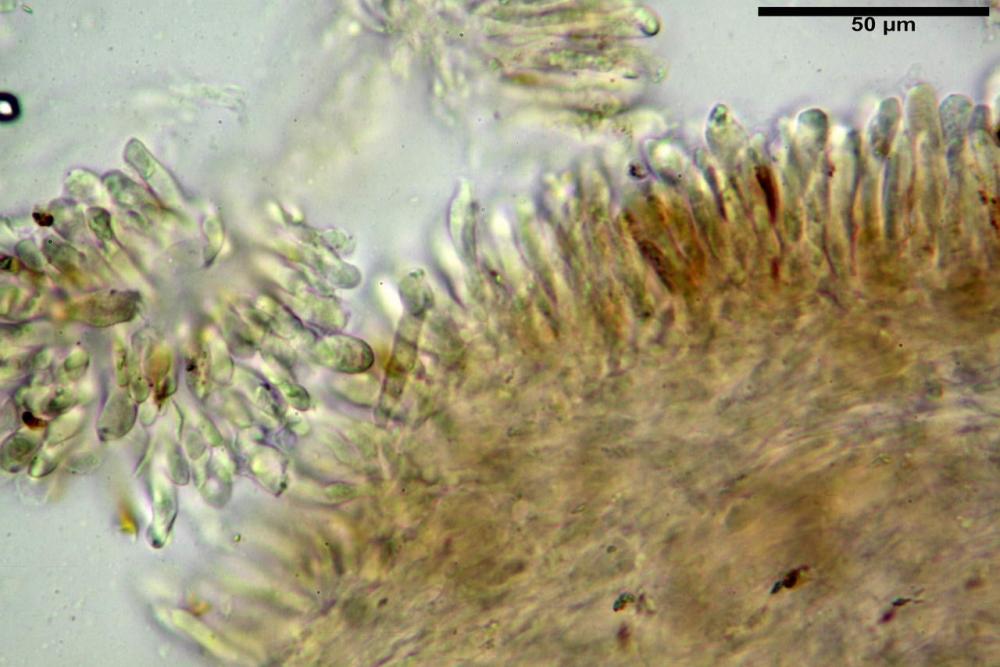
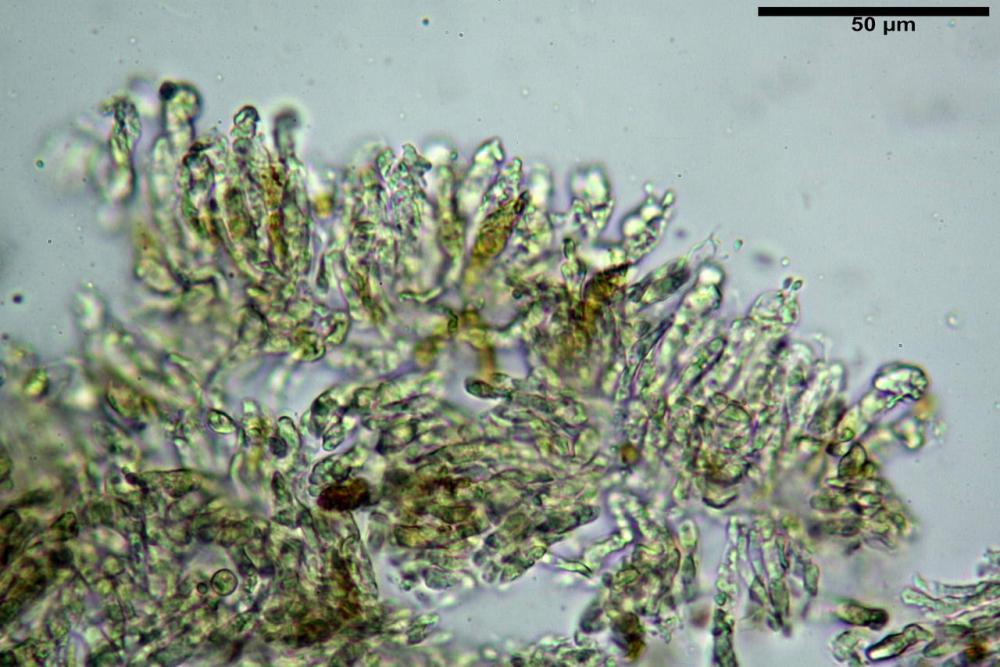
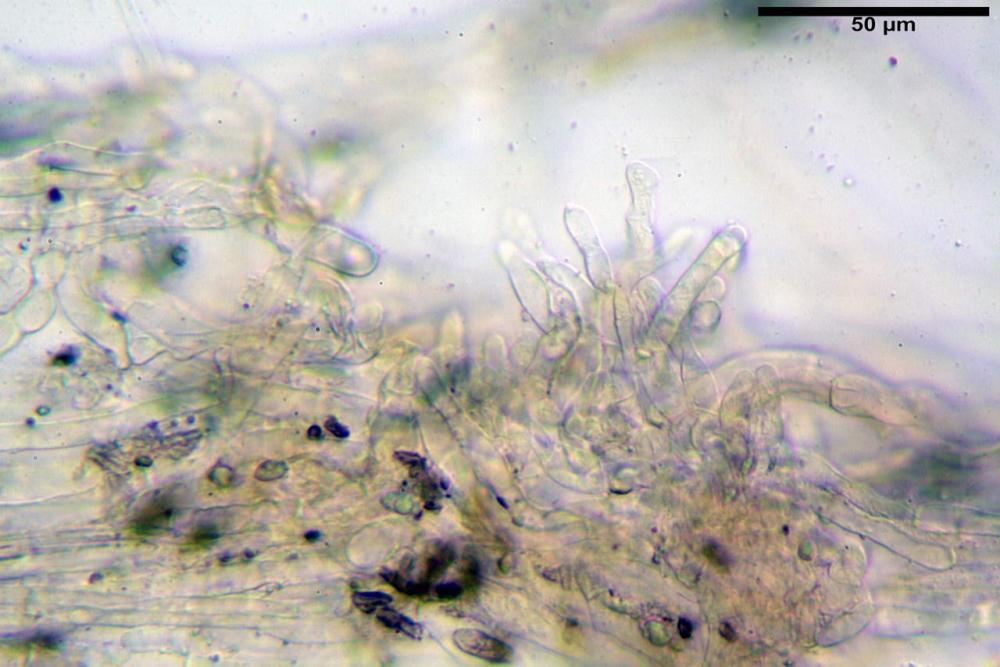
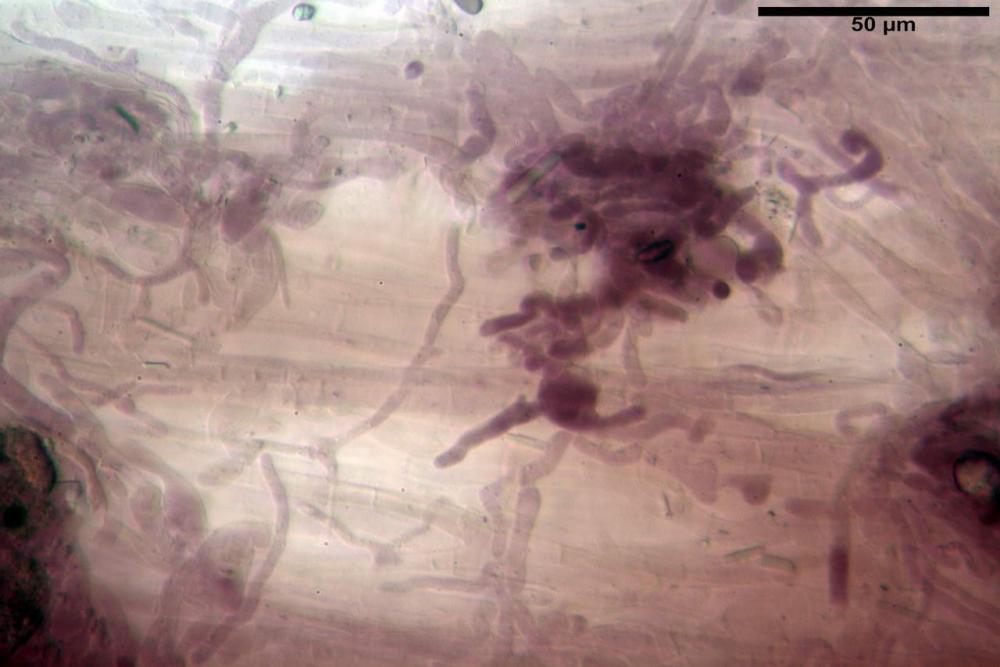
Pseudocheilocistidi 30,2-37,3 x 6,7-7,9 µm, Vol.m = 942 µm³, strettamente cilindrici, con apice da leggermente allargato a ristretto, in alcuni casi debolmente mucronato, ialini, con tracce di necropigmento, parete sottile.
Pleurocistidi non osservati.
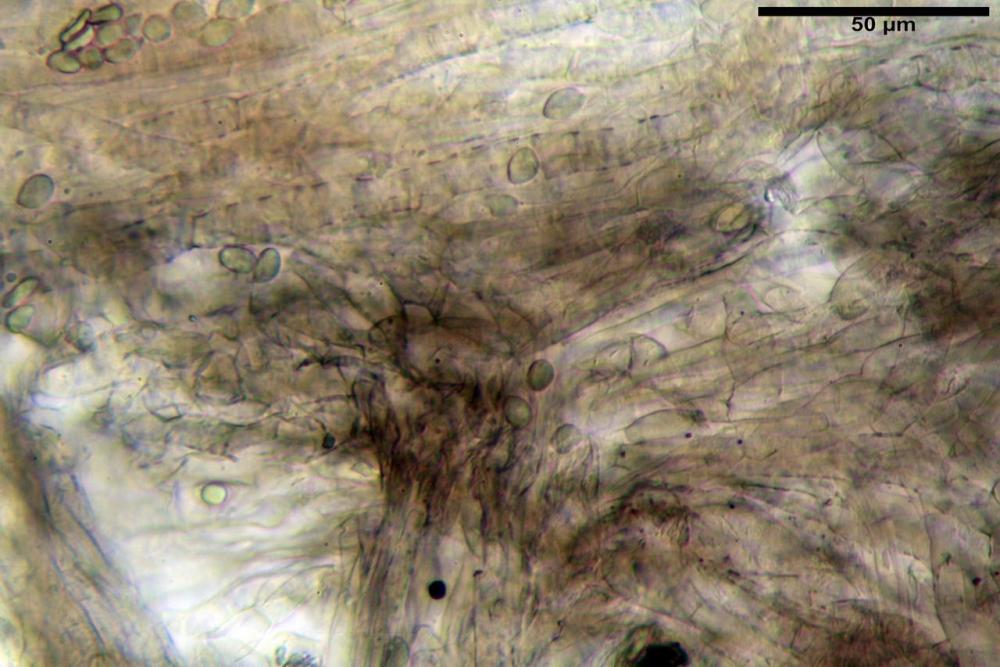
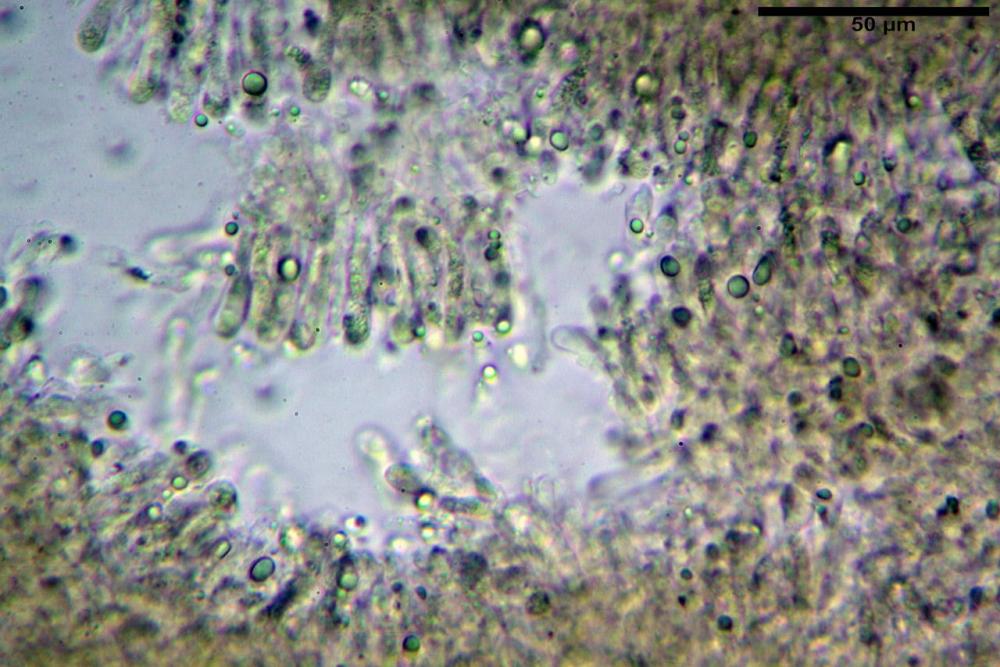
Pileipellis una cutis tendente ad un subtricoderma, composta da ife cilindriche, sinuose, variamente intrecciate, con terminali leggermente allargati ed emergenti, larghe 11-22 (31) µm, lunghe 34-107 µm. Nei campioni freschi osservati in acqua rilevato un evidente pigmento parietale incrostante ed un secondo extraparietale di colore bruno-rossastro. L’osservazione effettuata su materiale d’erbario dapprima in acqua e successivamente con idrato di potassio 5% ha evidenziato tre tipologie di pigmento, il primo incrostante, più o meno incrostante-zebrante, di colore nettamente verdastro, il secondo extracellulare, anch’esso di colore verdastro, il terzo di tipo intracellulare di colore giallastro uniforme, più evidente nelle cellule terminali.
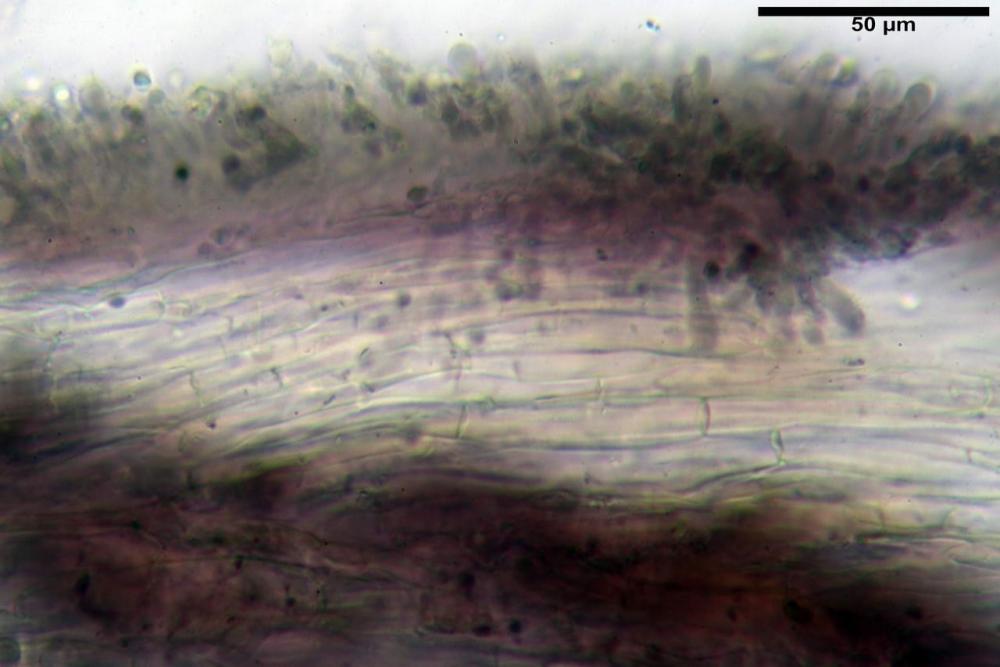
Caulopellis in superficie formato da ife cilindriche, a parete sottile, ialine, con setti ravvicinati, larghe 4-6 µm, alcune delle quali emergenti, con terminali (pseudocaulocistidi), da regolari a più o meno allargati, claviformi, perfino ampollacei, larghi 6-8 µm, macroscopicamente producono il tomento stipitale, lo strato più profondo è composto da ife di calibro maggiore, larghe 8-14 µm.
Giunti a fibbia assenti.
Materiale studiato ed ambiente delle raccolte: ITALIA, Trieste. Località: Rio Storto (Muggia). Coordinate geografiche: 45°35'50.72"N 13°45'48.54"E. Altezza 17 m s.l.m. Habitat: su terra nuda, nei pressi di un cedro. Raccolte: 27.05.1994 (n°0091); 04.07.2004 (n°2285). Leg. & det. Zugna. Località: Quartiere Campi Elisi, (Trieste città). Coordinate geografiche: 110: III: TRIESTE. Altezza 50 m s.l.m. Habitat: aiuola cittadina presso Cedrus deodara Don, terreno ricoperto da Parietaria officinalis L. Raccolte: 15.10.2015 (n°5604); 20.10.2015 (n°5843); 22.10.2015 (n°5844); 20.10.2016 (n° 5843); 21.10.2016 (n° 6830); 25.10.2016 (n° 6831). Leg. & det. Picciola.
Nella seconda stazione di raccolta sono stati rinvenuti esemplari di Echinoderma carinii (Bres.) Bon, Lepiota pseudofelina Lange, Leucoagaricus babosiae Bon, Rhodocybe gemina (Paulet) Kuyper & Noordel., Leucoagaricus leucothites (Vittad.) Wasser.
Osservazioni
Callistosporium olivascens è facilmente riconoscibile per la crescita terricola, le piccole dimensioni, la superficie asciutta, finemente feltrata, con colorazioni che spaziano dal bruno-grigiastro al bruno-olivastro fino al rossastro nelle condizioni di tempo umido, le lamelle spesse, spaziate, il gambo sovente eccentrico, obconico, feltrato, che termina con un fascio di rizomorfe biancastre che inglobano residui del substrato di crescita. A livello macroscopico segnaliamo inoltre la spettacolare reazione verde-blu a contatto con le basi, che si riproduce anche negli exsiccata.
A seconda delle sistematiche adottate dai diversi autori, C. olivascens è stato incluso nei generi Tricholoma (Fr.) Staude (BOUDIER, 1917; KÜHNER & ROMAGNESI, 1964; SINGER, 1986) e Callistosporium Sing. (BON, 1976; MOSER, 1986).
KÜHN & ROMAGNESI (1957) lo inseriscono nella sezione Pseudocollybia Kühn del sottogenere Inamoena, del genere Tricholoma, mentre SINGER (1986) lo colloca nella Sezione Adusta Sing. dello stesso genere.
BON (1976), invece, lo trasferisce nei Callistosporium Sing., inserendolo dapprima nel sottogenere Pseudocollybia Kühner ex Bon e successivamente nel sottogenere Xerophorus Bon (1990, 1991) che, come sopra riferito, contempla specie a lamelle spaziate, spore superiori a 8 µm e basidi slanciati.
Lo stesso BON istituisce in tempi diversi due nuove varietà di C. olivascens: la var. aerinum (BON, 1976) e la var. donadinii (BON, 1990).
La varietà aerinum, secondo lo specialista francese, si distinguerebbe dalla forma tipo per la cuticola dai colori brunastri con riflessi rossastro-porporini, il sapore amaro e le spore contenute entro i 10 µm di lunghezza.
La varietà donadinii, invece, differirebbe dalla forma tipo per le colorazioni pileiche nettamente rossastre e le spore inferiori ai 10 µm. In seguito Contu (1993) ha elevato questa varietà a rango di specie.
Tuttavia, siamo propensi a ritenere queste varietà delle semplici manifestazioni di una stessa specie, la cui variabilità di alcuni caratteri è fortemente influenzata dalle condizioni d’umidità presenti al momento della raccolta, al diverso grado di maturazione dei basidiomi, al substrato di crescita e alla diversa frequenza di basidi mono-bi e tetrasporici, come evidenziato da BIZIO (1991) per una raccolta effettuata nella laguna veneta caratterizzata da una prevalenza di basidi bisporici su quelli monosporici e l’assenza di basidi tetrasporici.
Pertanto, consideriamo C. olivascens una specie alquanto variabile sia nei caratteri macroscopici (colorazioni dei basidiomi, igrofania, dimensioni, sapore, odore) che in quelli microscopici (dimensioni sporali, numero sterigmi, pigmenti).
Consideriamo il colore pileico di T. olivascens un carattere piuttosto mutevole in relazione alle diverse condizioni climatiche nelle quali si possono sviluppare i basidiomi.
Ad esempio, abbiamo riscontrato nel pileo una prevalenza di tinte rossastre e l’assenza di pruina nelle raccolte effettuate in condizioni di tempo molto umido. Tali manifestazioni di C. olivascens sono da ricondurre alla var. donadinii.
Invece, nelle raccolte effettuate in condizioni di tempo asciutto e ventoso abbiamo riscontrato sulla superficie pileica dei basidiomi una prevalenza di colorazioni grigiastre, bruno-grigiastre ricoperte da un sottile strato pruinoso, tale forme sono tipiche della varietà aerinum.
Per quanto riguarda le dimensioni sporali, abbiamo potuto appurare nei nostri rilievi un’ampia variabilità nelle diverse raccolte esaminate, sei delle quali provengono dalla medesima stazione di crescita.
In due raccolte hanno superato di poco i 9 µm (n° 0091; n° 6799), mentre in quella con il codice identificativo n°5844 hanno oltrepassato la media di 10 µm, raggiungendo nei valori massimi i 12-15 µm di lunghezza.
Tale fenomeno (dimorfismo sporale) è a nostro avviso da ricondurre alla diversa incidenza di basidi bisporici o tetrasporici, come sostenuto da MOSER (1986b) e BIZIO (1991). Abbiamo inoltre riscontrato tutta una serie di valori intermedi che fanno ulteriormente propendere all’ipotesi di un’unica specie ad ampio spettro nei valori sporali.
Nelle nostre indagini microscopiche abbiamo potuto apprezzare i pigmenti presenti nelle diverse strutture indagate.
Nei campioni freschi osservati in acqua si è rilevata la presenza di un pigmento verdastro all’interno dei basidi sotto forma di granulazioni che reagiscono con le basi assumendo una colorazione più intensamente verdastra e brillante.
Nei campioni d’erbario, invece, si è appurato che questo pigmento non appare più sotto forma di granulazioni disperse nei basidi e negli sterigmi, ma è incluso nelle guttule, le quali negli esemplari freschi apparivano ialine.
Nella pileipellis osservata su materiale fresco abbiamo rilevato la presenza di due pigmenti: uno nettamente incrostante di colore verdastro e l’altro extracellulare di colore bruno-rossastro. Nei secchi è stata individuata una terza tipologia di pigmento di natura intracellulare, che ci risulta più evidente negli articoli superficiali. Il pigmento parietale reagisce istantaneamente a contatto con le basi assumendo una colorazione marcatamente verdastra e fuoriesce dalle pareti ifali colorando di verdastro la pileipellis.
Nell’ambito di uno studio effettuato da MOSER (1986b) basato sull’analisi cromatografica dei pigmenti nei Callistosporium si apprende l’esistenza in C. olivascens di alcune sostanze di natura antrachinonica e soprattutto un ampio spettro di sostanze fluorescenti di colore giallastro, verdastro, blu-verdastro, azzurrognolo e arancio. Tali sostanze sarebbero abbastanza sensibili e il loro numero potrebbe variare in relazione allo sviluppo e alle condizioni degli sporofori (MOSER, 1986b).
Per quanto riguarda le caratteristiche ecologiche di questo taxon, la letteratura consultata certifica un indubbio legame con il genere Cedrus Trew (KÜHN & ROMAGNESI (1964); BON, 1976, 1991; MOSER, 1978, 1986; CETTO, 1994; CONSIGLIO & PAPETTI, 2001; GALLINARI & GILIANI, 2007; NONIS, 2009; ANGELI & TULLII, 2011; BOCCARDO et al., 2013), più raramente sotto Cupressaceae (BON, 1984; CONSIGLIO & PAPETTI, 2001) e Pinus spp. (MOSER, 1986b; CONTU, 1993), con una preferenza per gli ambienti antropizzati, come le aiuole, giardini e parchi cittadini (LANZONI, 1986; PERCO, 1988; BIZIO, 1991; CACIALLI & CAROTI, 2005). La varietà aerinum è stata rinvenuta in ambiente dunale nelle vicinanze di ginepri (BIZIO, 2012).
Callistosporium olivascens è da considerare un taxon relativamente comune, a distribuzione perlopiù submediterranea. In Italia i suoi ritrovamenti si concentrano lungo la costa, tuttavia sono stati effettuati diversi ritrovamenti nell’entroterra, in particolare nella fascia pianeggiante.
Si è a conoscenza di ritrovamenti effettuati in Sardegna (CONTU, 1993), Puglia (RICCI, 2000, MCVE22884); Lazio (DI PALMA, 2016), Toscana (CACIALLI & CAROTI, 2005; MONTI et al., 2001; BORGHI, in MOSER 1986b), Marche (AGOSTINELLI, 2010), Emilia Romagna (Donelli & Simonini, 1987, MCVE18873; Angeli & Tullii, 2009; Zuccherelli et al., 2001; Lanzoni, 1986), Lombardia (Gallinari & Giliani, 2007), Veneto (Bizio, 1991 MCVE192; Bizio, 1995, MCVE 8468; Di Piazza, 1996, MCVE11762; Cugildi & Bizio, 1999, MCVE14926; Bizio & Lorenzon, 2007, MCVE7859; Bizio, 2010, MCVE27027; Angelini, 2014, MCVE28690), Friuli Venezia Giulia (Nonis, in Moser 1986b; Perco, 1988; Ricci & Cautero, 1992, MCVE7473; Cautero, 1994, MCVE5146; Zecchin, 1996, MCVE10189; Bersan, 2000, MCVE23177; Zugna, 2004; Bizio, 2013, MCVE27956).
Callistosporium luteo-olivaceum (Berk. & M.A. Curtis) Singer
Lloydia 89: 117 (1946)
Etimologia: dal latino “luteo-olivaceum” per i colori giallo-oliva che assumono i basidiomi.
Typus North Carolina, U.S.A., Curtis (FH).
Basionimo: Agaricus luteo-olivaceus Berk. & M.A. Curtis, Ann. Mag. nat. Hist., Ser. 3 4: 286 (1859)
Sinonimi: ≡ Collybia luteo-olivacea (Berk. & M.A. Curtis) Sacc., Syll. fung. (Abellini) 5: 215 (1887)
≡ Agaricus coloreus Peck, Bull. Buffalo Soc. nat. Sci. 1(2): 46 (1873) [1873-1874]
= Agaricus rubescentifolius Peck, Rep. (Annual) Trustees State Mus. Nat. Hist., New York 39: 38 (1887) [1886]
= Tricholoma rubescentifolium (Peck) Sacc., Syll. fung. (Abellini) 9: 15 (1891)
= Collybia colorea (Peck) Sacc., Syll. fung. (Abellini) 5: 230 (1887)
= Collybia colorea var. rubescentifolia (Peck) Peck, Ann. Rep. Reg. N.Y. St. Mus. 49: 65 (1897) [1896]
= Tricholoma elaeodes Romagn., in Kühner & Romagnesi, Bull. Soc. nat. Oyonnax 8: 96 (1954)
= Callistosporium elaeodes (Romagn.) Bon, Docums Mycol. 6(nos 22-23): 282 (1976)
= Callistosporium favrei Singer, Sydowia 30(1-6): 262 (1978) [1977]
= Callistosporium graminicolor Lennox, Mycotaxon 9(1): 152 (1979)
= Callistosporium luteofuscum Singer, Lilloa 26: 115 (1954) [1953]
= Callistosporium luteofuscum var. maior Singer, Beih. Nova Hedwigia 29: 53 (1969)
= Callistosporium majus Singer, Sydowia 30(1-6): 262 and 263 (1978) [1977]
= Callistosporium minor (Verbeken & Walleyn) M. Wilh., Schweiz. Z. Pilzk. 85(4): 137 (2007)
= Callistosporium psilocybe Murrill & Singer, Mycologia 36(4): 363 (1944)
= Collybia xanthophylla Malençon & Bertault, Docums Mycol., mém. hors sér. 33: 406 (1975)
= Callistosporium xanthophyllum (Malençon & Bertault) Bon, Docums Mycol. 6(no. 24): 52 (1976)
= Calocybe olivascens (Maire) Singer, Annls mycol. 41(1/3): 107 (1943)
= Collybia elaeodes Romagn., in Kühner & Romagnesi, Bull. Soc. nat. Oyonnax 8: 74 (1954)
= Collybia rubescentifolia (Peck) Peck, Rep. (Annual) Trustees State Mus. Nat. Hist., New York 41: 83 (1888)
= Psilocybe floridana Murrill, Proc. Fla Acad. Sci. 7(2/3): 126 (1945) [1944]
= Tricholoma chrysenteron var. olivascens Maire, Publ. Inst. Bot. Barcelona 3(no. 4): 87 (1937)
Diagnosi originale
59. A. (Collybia) luteo-olivaceus, B. & C. Parvus, luteo-olivaceus; pileo convexo-umbilicato glabro tenui; stipite leviter fistuloso, subtiliter furfuraceo flexuoso; lamellis adnatis. Curt. no. 5728. On old stumps in wet woods, Aug. 1856, C.J. Sprague.
Pileus ½ an inch across, convex, slightly umbilicate, thin, smooth, opake when wet, shining when dry, olive-yellow; stem 1 ½ inch long, 1 line thick, flexuous, minutely fistulose and scurfy, of a dirty ochre; gills crowded, adnate, of the same colour as the pileus, moderately broad. Spores white, subelliptic. Evidently allied to A. trochilus.
Descrizione delle raccolte studiate
Portamento collybioide, di piccole-medie dimensioni.
Modalità di crescita singola o in piccoli gruppi subcespitosi.
Pileo fino a 50 mm di diametro, poco carnoso, inizialmente subgloboso, in alcuni esemplari con leggera ombelicatura, presto convesso, in seguito progressivamente appianato, infine debolmente depresso; margine involuto, sottile, debolmente striato per trasparenza in condizioni d’elevata umidità, altrimenti liscio, un po’ sinuoso, rivestimento pileico non separabile, glabro, igrofano, leggermente vischioso e brillante a tempo umido, presto asciutto, di colore piuttosto variabile, giallo miele, giallo ambrato su esemplari freschi e ben idratati, in seguito subentrano tinte giallo-olivastre, giallo-ocra-olivastre, a macchie nero-olivastre, infine grigio-brunastro con una leggera pruina superficiale.
Lamelle da adnate a smarginate, piuttosto fitte, mediamente spesse, ondulate, intervallate da lamellule di diversa lunghezza, inizialmente di un bel color giallo zafferano, con tendenza a macchiarsi di grigio-olivastro, filo liscio, concolore.
Stipite 30-60 x 3-5 mm, cilindraceo, un po’ compresso, slanciato, sinuoso, fistoloso, assottigliato alla base, di consistenza cartilaginea, superficie liscia, percorsa da fibrille innate longitudinali, asciutta, lucente, di colore inizialmente giallo-olivastro, presto volgente su tinte grigio-olivastre, grigio-ocracee, forforaceo all’apice, base ricoperta da uno strato cotonoso biancastro.
Carne scarsa, igrofana, un po’ traslucida, di colore ocra-bruno-olivastro, fibrosa nel gambo, sapore amarognolo, odore leggero, un po’ sgradevole, ma poco definibile.
Sporata bianco crema.
Macroreazioni su esemplari appena raccolti le superfici a contatto con ammoniaca 3% si tingono rapidamente e intensamente di rosso; ponendo dei frammenti di exsiccata in ammoniaca 25% si osserva che questa si colora abbastanza velocemente di rosso porpora.
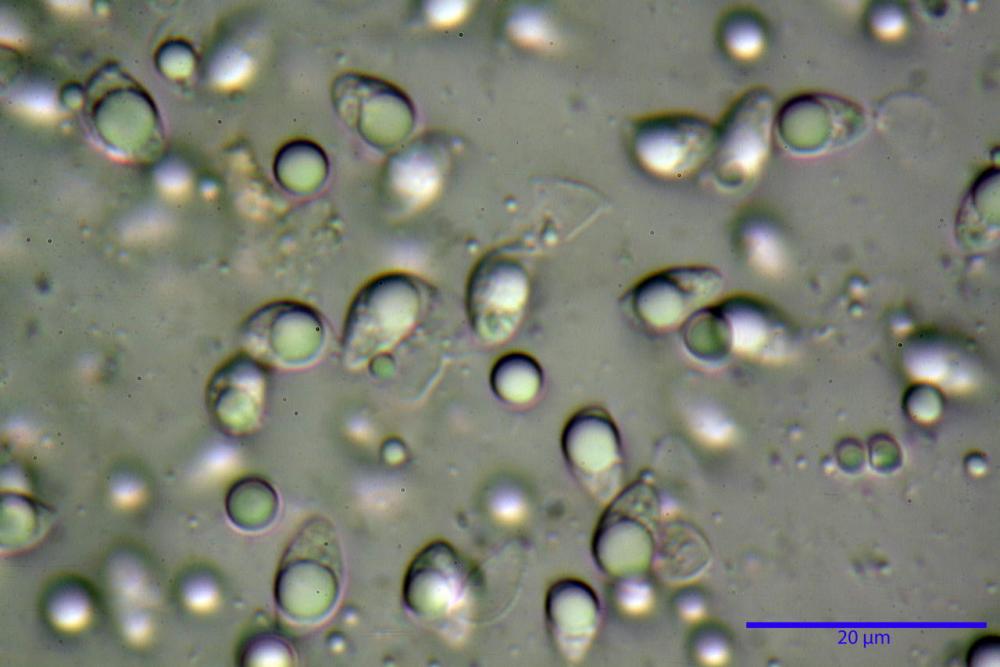
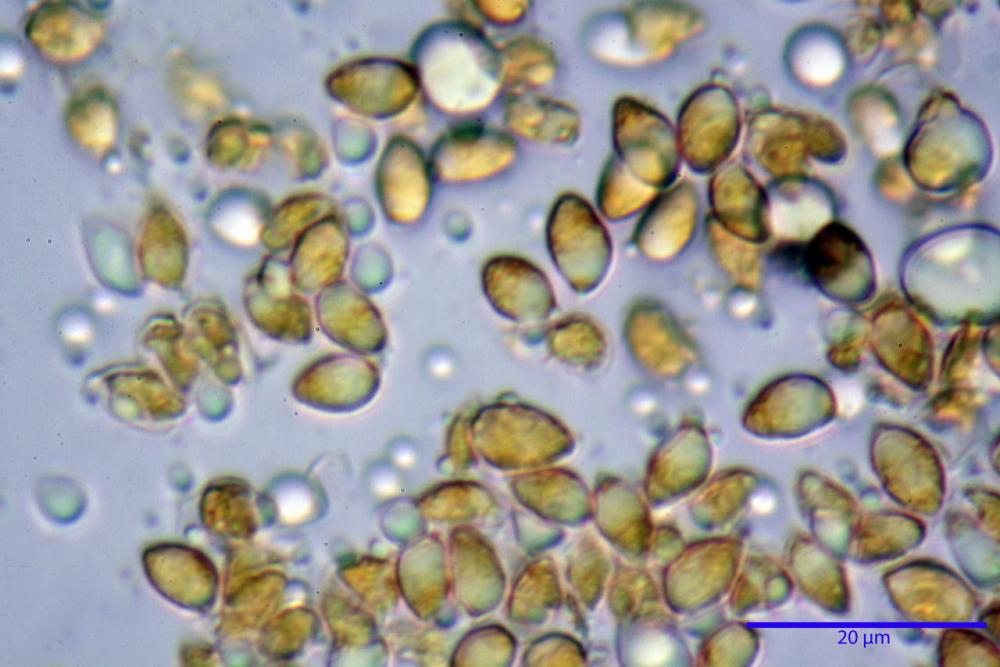
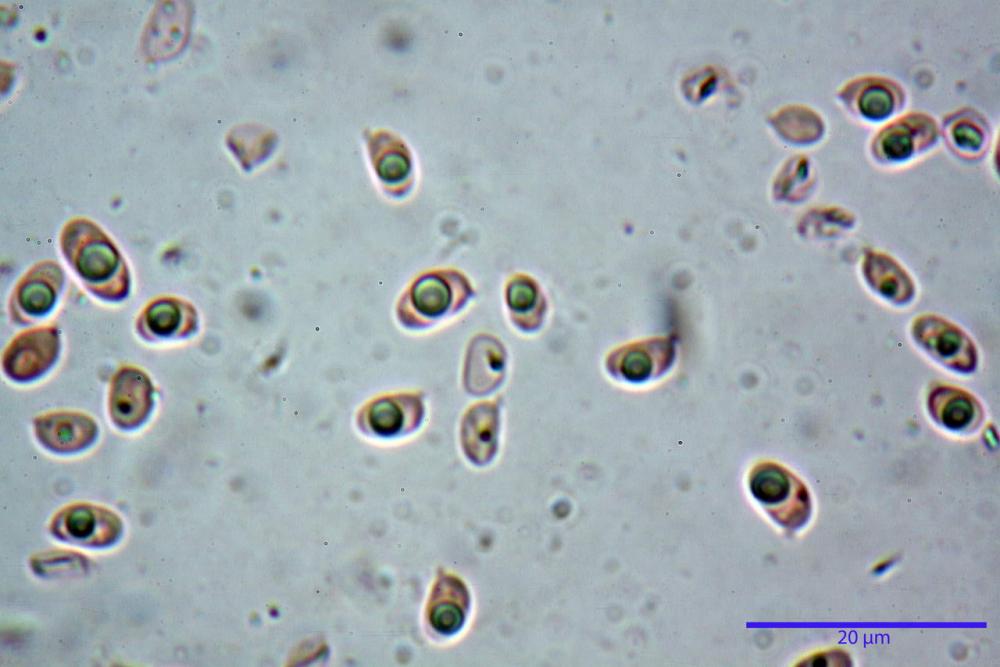
Spore (3,21) 3,93-6,66 (9,92) x (2,35) 2,78-4,13 (4,87) µm, in media 5,56 x 3,57 µm, Q. = (1,19) 1,35-1,77 (2,27), Q.m. = 1,55, Vol. = (9,5) 15,7-56,7 (118,4) µm³, Vol.m = 38,69 µm³, (n =612, sei raccolte), in proiezione laterale ellissoidali con il lato adassiale appiattito; in proiezione frontale ellittiche, ialine, a parete sottile, inamiloidi, apiculo breve ma ben distinto. Su campioni freschi l’osservazione in acqua ha rilevato la presenza di una grande guttula di colore giallo-verdastro brillante, ben evidente anche in ammoniaca 3% e idrato di potassio 5%, nettamente rossastra in ammoniaca 6%.
Negli exsiccata osservati in acqua la guttula è rossastra, tale colorazione diviene ancor più intensa in ammoniaca 25% e idrato di potassio 5%.
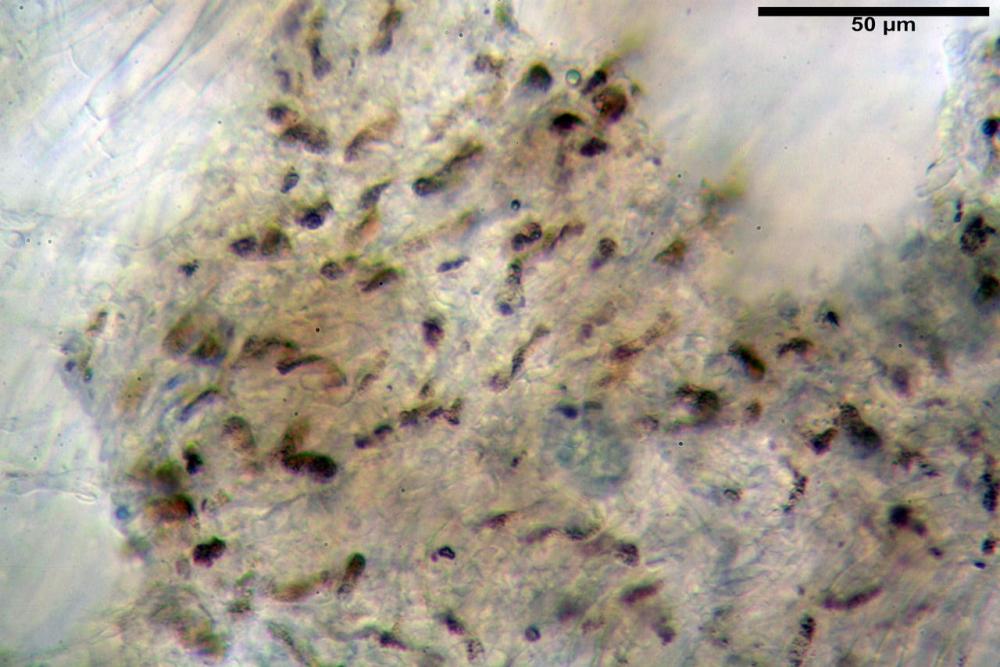
Basidi 20,1-28,1 x 4,8-6,5 µm, Vol.m = 433 µm³, claviformi, a parete sottile, con guttule ialine nei campioni freschi, in maggioranze tetrasporici, rari quelli bisporici, con sterigmi lunghi 3-5 µm, ancor più rari quelli monosporici, con lo sterigma che raggiunge la lunghezza di 7 µm. Nei campioni freschi osservati in acqua si evidenzia internamente un pigmento granuliforme giallo-oro rifrangente, in ammoniaca 3% e potassio idrato 5% assume una colorazione grigio-verdastra, in ammoniaca 6% reagisce positivamente colorandosi di rosso porpora, in potassio idrato 30% la reazione è positiva ma più blanda, in ammoniaca 25% il pigmento rossastro fuoriesce dai basidi e si diffonde colorando leggermente le cellule imeniali.
Su exsiccata osservati in acqua tale pigmento appare da subito rossastro, rosso porpora, tale colorazione diviene ancor più intensa in ammoniaca 25%.
Trama lamellare regolare, formata da ife parallele, cilindriche, ialine, a parete sottile, con diametro 7-13 µm, lunghe 30-115 µm.
Pseudocheilocistidi 23,3-33,6 x 3,5-5,2 µm, Vol.m = 294 µm³, flessuosi, strettamente cilindrici, con apice da leggermente allargato a ristretto, in alcuni casi debolmente mucronato, ialini, a parete sottile, con evidente necropigmento rosso porpora in ammoniaca 25% nei campioni secchi.
Pleurocistidi non osservati.
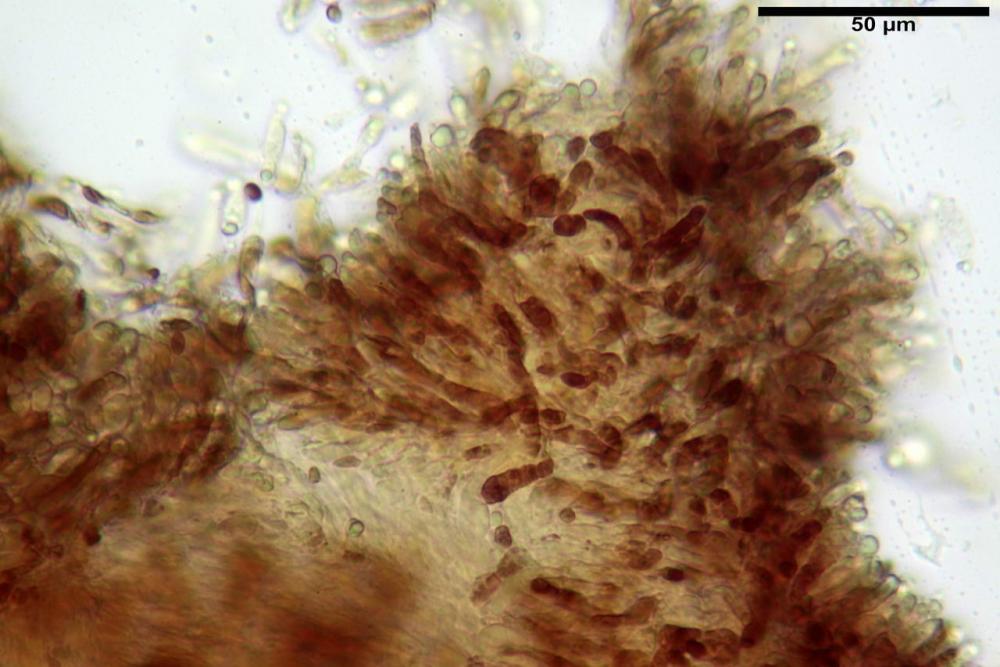
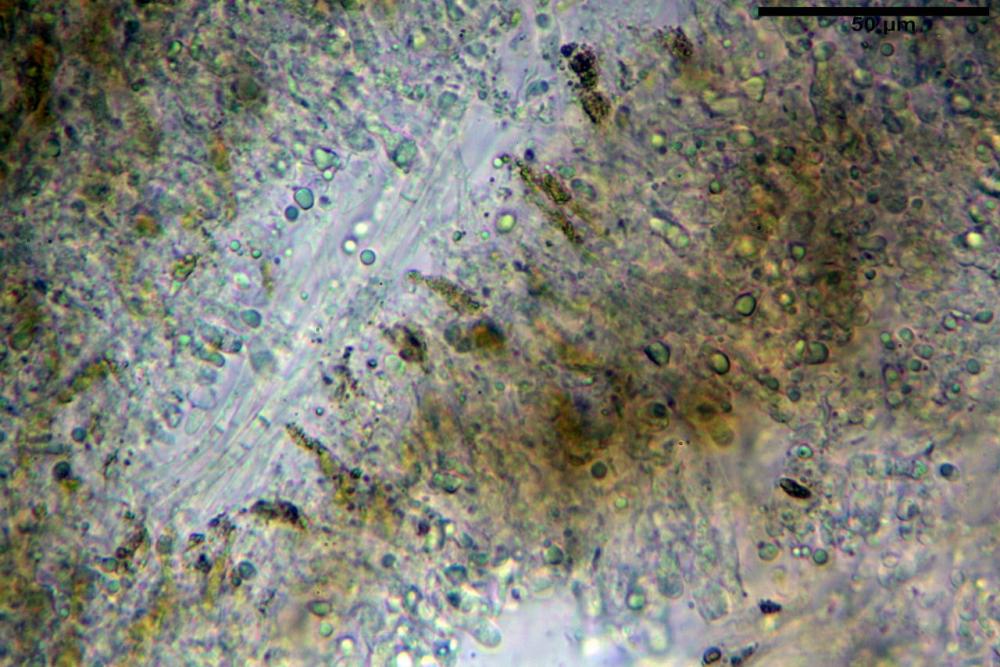
Pileipellis un subtricoderma composto da ife cilindriche di calibro (3,4) 3,9-5,9 (6,4) µm, in media 3,95 µm, con terminali claviformi, larghi (6,7) 6,8-17,4 (18,0) µm, in media 11,44 µm, le ife superficiali con pigmento incrostante giallo oro ben evidente in acqua negli esemplari freschi, rossastro negli exsiccata reidratati con idrato di potassio 2%.
Caulopellis composta da ife parallele, larghe 3-8 µm, ialine, rossastre in idrato di potassio 2%, con diversi peli caulinari, simili a pseudocistidi, sinuosi, cilindrici o strettamente claviformi,
Giunti a fibbia assenti.
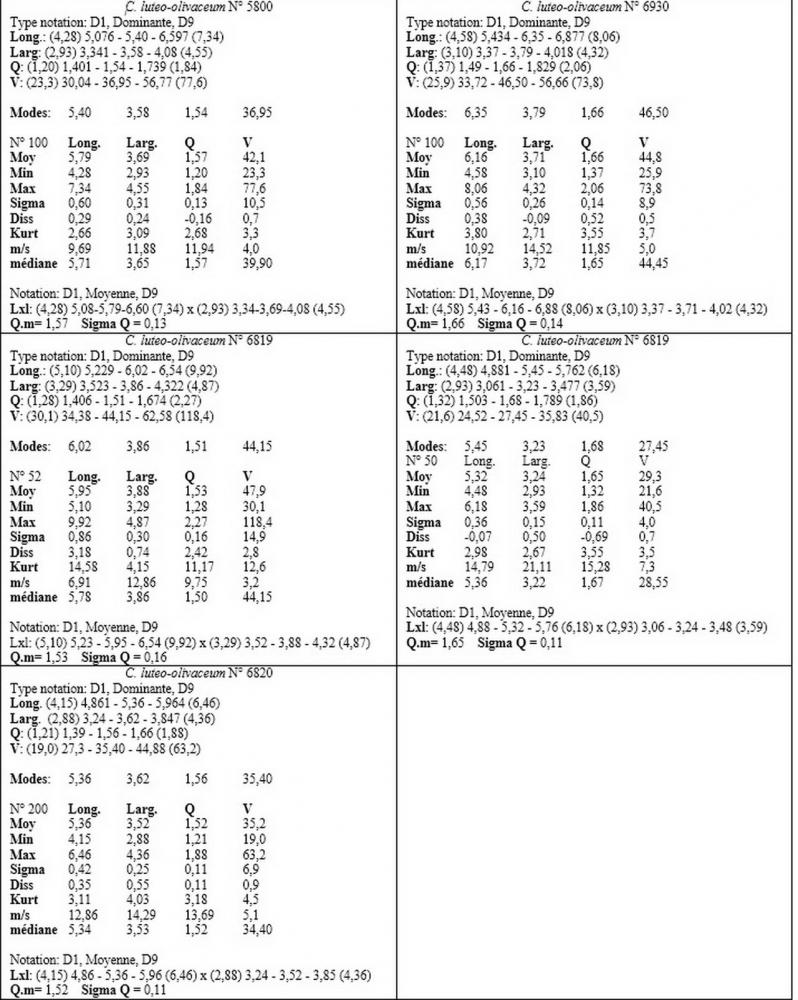
Materiale studiato ed ambiente delle raccolte: ITALIA, Friuli Venezia Giulia, Trieste. Località: Bosco del Farneto. Coordinate geografiche: 110312. Altezza 80 m s.l.m. Habitat: su ceppaia degradata di Pinus nigra Arnold. Raccolte 12.11.2012 (n°5799); 19.11.2012 (n°5800); 22.10.2016 (n°6821); 3.11.2016 (n°6819); 8.11.2016 (n°6820). Località: Parco di Miramare. Coordinate geografiche 45°42'16.18"N 13°42'52.37"E. Altezza 20 m s.l.m. Habitat: su ceppaia di Pinus pinea L. Raccolta 11.12.2016 (n°6930). Leg. & det. Picciola.
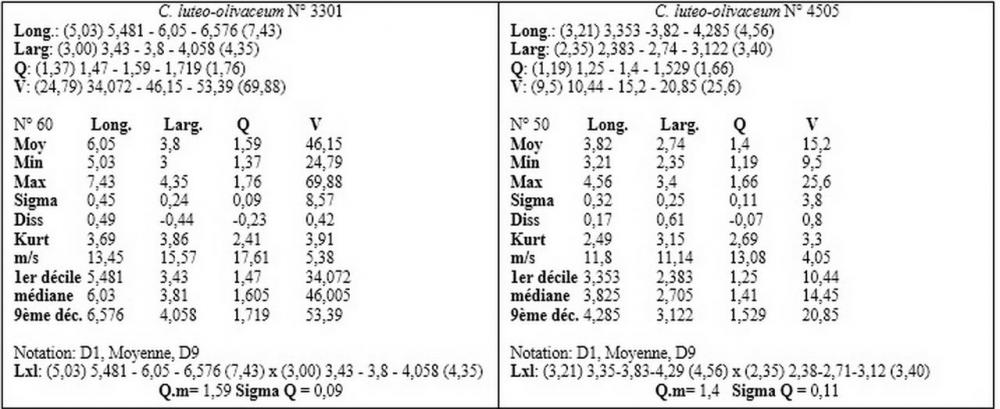
Materiale aggiuntivo di Callistoporium pinicola: ITALIA, Abruzzo, Torricella Sicura. Località: Magliano di S. Stefano. IGM: 339; III; TERAMO. Altezza 900 m s.l.m. Habitat: nei pressi di una ceppaia di quercia, su terra nuda. Raccolta 5.8.2006. (n°3301). Leg. de Ruvo & det. Zugna. Rocca Santa Maria. Località: Ceppo-Morricana. IGM: 339; III; TERAMO. Altezza 1200 m s.l.m. Habitat: su ceppaia marcescente di abete. Raccolta 21.7.2010. (n°4505). Leg. de Ruvo & det. Zugna.
Osservazioni
Sul campo C. luteo-olivaceum si fa riconoscere per le piccole dimensioni, il portamento collybioide, la superficie pileica liscia, alquanto variabile nei colori, spesso pruinosa, le lamelle fitte di un bel colore giallo-oro, il sapore un po’ amaro, l’assenza di odori particolari e la crescita subcespitosa su legno morto in disfacimento, per lo più di conifera (Pinus spp.). Per una conferma macroscopica della specie è sufficiente ricorrere all’ammoniaca 3% che provoca una spettacolare reazione rosso-porpora a contatto con le superfici.
La presenza, in questa specie, di caratteri non sempre costanti nella colorazione pileica, nell’igrofania, nel sapore, nell’odore e nelle dimensioni sporali, unitamente alla crescita in aree geograficamente molto distanti tra loro e in climi molto diversi, hanno portato nel tempo alla creazione di diverse specie che si sono dimostrate in seguito essere conspecifiche.
E’ stato Singer (1970), dopo aver istituito alcuni taxa fulcranti attorno al C. luteo-olivaceum, ad aver riconosciuto a questa specie una notevole variabilità cromatica dei basidiomi inclusi alcuni suoi caratteri microanatomici, ponendola così in sinonimia con alcune specie americane.
In seguito, Readhead (1982) ha ulteriormente ampliato il concetto di specie enunciato da SINGER riconoscendo una conspecificità tra C. luteo-olivaceum e C. xanthophyllum (Malençon & Bertault) Bon, quest’ultimo binomio ad areale mediterraneo.
Di diverso avviso è stato Bon (1991), il quale ha preferito mantenere separata la specie europea, C. xanthophyllum, da quella americana, C. luteo-olivaveum, in quanto quest’ultima è stata accreditata per avere un sapore pungente o amaro e le lamelle ancor più fitte.
A sostenere la tesi di Readhead (1982) è stato Moser (1986,b), introducendo nello studio dei Callistosporium, l’analisi cromatografica dei pigmenti.
Mediante l’analisi cromatografica, Moser ha rilevato la presenza in C. xanthophyllum di pigmenti antrachinonici, in particolare di skirina ed il dimero ipericina (caso unico tra le Tricholomataceae) ed uno spettro del tutto uguale a quello di C. luteo-olivaceum (Moser, 1986).
Readhead (1982) nel suo importante lavoro, ha riconosciuto la conspecificità di C. luteo-olivaceum con le seguenti specie europee: C. elaeodes (Romagn.) Bon e C. favrei Sing.
C. elaeodes è stato istituito da Romagnesi (1954) sulla base di una raccolta francese? che a dispetto del taxon americano presentava delle tinte verdastre, una maggiore esilità dei basidiomi, la crescita su residui legnosi di latifoglia e spore più grandi, di dimensioni 6,5-7,2-(7,5) x 3,5-4-(4,5) µm (Kühner & Romagnesi, 1954; Bon 1976, 1991; Moser, 1986).
C. favrei è stato invece proposto da Singer (1978) sulla base di una revisione di una raccolta svizzera effettuata da Favre rinvenuta su legno marcescente di Picea, il cui carattere distintivo è costituito dalle spore di dimensioni notevoli, misuranti 5,8-9,7 x 2,8-4,5 µm (Singer, 1978).
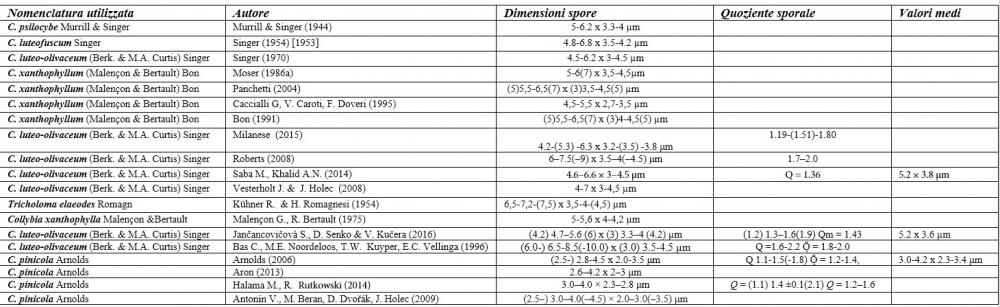
Recentemente, nell’ambito dei Callistosporium europei, Arnolds (2006) ha istituito una nuova entità, Callistosporium pinicola Arnolds, differenziandola dal C. luteo-olivaceum per le spore più piccole, non oltrepassanti i 5 µm di lunghezza, l’odore farinaceo e il sapore da amarognolo ad amaro.
Questo Callistosporium è stato rinvenuto su tronchi e ceppaie degradate di conifere (P. sylvestris, P. pinea, Picea abies e Abies alba) e più raramente di latifoglie (Fagus sylvatica) nei paesi del centro e del nord Europa (Arnolds, 2006; ANTONÍN et al., 2009; HALAMA & RUTKOWSKI, 2014; JANČOVIČOVÁ et al., 2016).
Nel nostro erbario abbiamo una accolta di de Ruvo (21.7.2010, n°4505) caratterizzata da misure sporali perfettamente sovrapponibili a quelle di C. pinicola, ossia 3,21-4,56 x 2,35-3,4 µm, media 3,82x2,74 µm, Q 1,19-1,66, Qm 1,4, raccolta su ceppaia marcescente di abete in provincia di Teramo.
Come sopra accennato, C. luteo-olivaceum è da ritenere una specie alquanto variabile sia nei caratteri macroscopici (colorazione dei basidiomi, igrofania, caratteri organolettici), sia in quelli micromorfologici (dimensioni sporali, diversa incidenza di basidi mono-bi-tri e tetrasporici).
La variabilità cromatica di C. luteo-olivaceum è legata essenzialmente alla presenza di pigmenti antrachinonici (Moser, 1988b) liposolubili di colore giallo-oro, giallo brillante presenti nelle spore, nei basidi e nelle ife superficiali della pileipellis.
Le indagini microscopiche effettuate sia su esemplari freschi sia su exsiccata ci ha permesso di apprezzare l’evoluzione cromatica di questi pigmenti, che passano da tinte giallo-oro nei basidiomi appena raccolti a tinte rosso-porpora nei secchi (osservazione in acqua).
A nostro avviso sono molto interessanti le reazioni evidenziate con le basi (ammoniaca e idrato d’ammonio) a diverse concentrazioni.
In ammoniaca 3% e potassio idrato 5% gli elementi imeniali e quelli della pileipellis perdono la colorazione brillante giallo-oro, assumendo una tinta spenta, grigio-verdastra.
La reazione positiva all’ammoniaca si manifesta a una concentrazione del 6%, poiché i pigmenti antrachinonici assumono una tinta di un bel rosso-porpora intenso nei basidi, nelle spore e nelle ife superficiali della pileipellis.
Con il potassio idrato 30% la reazione è positiva ma più blanda, in ammoniaca 25% invece il pigmento rossastro fuoriesce dai basidi colorando leggermente le cellule imeniali.
A livello macroscopico, tale viraggio dei pigmenti originari giallo-oro si evidenzia molto bene sui basidiomi freschi sia a contatto con l’ammoniaca 3%, la quale sviluppa rapidamente sulle superfici una colorazione rossastra, sia spontaneamente, con il verificarsi di particolari condizioni di tempo secco, attraverso la formazione di macchie rosso-porpora più o meno estese rintracciabili sulle lamelle o sulla superficie pileica (fenomeno spontaneo dovuto all’essicazione).
Un simile carattere è stato ad esempio riscontrato nella specie nordamericana Agaricus rubescentifolius Peck, ritenuta anch’essa da REDHEAD (1982), una forma ecologica assimilabile a C. luteo-olivaceum, caratterizzata per l’appunto dalle macchie rosso ematite diffuse sulle lamelle e sul pileo. Lo stesso fenomeno è riportato da PANCHETTI (2004) in una raccolta effettuata nel ravennate.
Anche le nostre raccolte di C. luteo-olivaceum hanno evidenziato una notevole variabilità cromatica della superficie pileica, la quale è passata da tinte giallo-oro, giallo-miele a tempo umido, a tinte giallo-olivastre, con macchie olivastre più o meno estese, fino a colorazioni ocra-giallo-olivastre negli esemplari vetusti.
Per quanto concerne le dimensioni sporali, i nostri rilievi hanno evidenziato anche per questo Callistosporium una notevole variabilità nei valori dimensionali anche all’interno di una stessa raccolta.
I valori minimi ottenuti si sovrappongono a quelli di C. pinicola, ossia quelli compresi tra 3,21 e 4,75 µm, mentre i valori massimi, compresi tra 6,66 e 9,92 µm, si sovrappongono alle misure sporali di C. eleodes e C. favrei.
Tale variabilità è in parte legata alla diversa frequenza di basidi mono-bi e tetrasporici e al suo vasto areale di crescita che si estende dal Nord al Sud America, dal Nord Africa all’Eurasia, compresa la regione hymalayana occidentale del Pakistan (Saba & Khalid, 2014).
Pertanto, sulla base di quanto esposto, si ritiene che questo taxon si sia adattato a svilupparsi in ambienti e climi molto diversi: dalle foreste tropicali e subtropicali delle Americhe, agli ambienti mediterranei del Nord Africa e del Sud Europa, alle zone temperate e continentali dell’emisfero boreale, fino agli ambienti freddi d’alta quota (Hymalaya).
In Europa cresce su legno morto e degradato (tronchi caduti, rami, trucioli, segatura) principalmente di conifere (Picea, Pinus) e più raramente di latifoglie, dove si rinvengono le rare forme a tinte verdastre e con grandi spore (C. elaeodes).
Sul territorio italiano questo taxon è ampiamente distribuito, ma i suoi siti di crescita sono abbastanza rari e perlopiù localizzati in ambiente costiero, dove è stato rinvenuto soprattutto su legno morto di Pinus pinea L. (CACIALLI, CAROTI & DOVERI, 1995; PANCHETTI, 2004).
Sulla base delle nostre conoscenze, Callistosporium luteo-olivaceum è stato rinvenuto nelle seguenti regioni: Sicilia (La Rocca & Robich, 1998, MCVE14096), Abruzzo (De Ruvo, 2010), Campania (Di Palma, 2016 - A.M.I.N.T.), Toscana (Caccialli, Caroti & Doveri, 1995; Levorato & Pergolini, 1996, MCVE12243; Papetti & Zovadelli, 2016), Liguria (Calledda, 2016 - A.M.I.N.T.), Lazio (Donelli & Simonini, 1986, MCVE18849; Cittadini, 2016 - A.M.I.N.T.; Lezzi, 2016 - A.M.I.N.T.![]() , Emilia Romagna (Panchetti, 2004; Angeli, 2009, MCVE24450), Veneto (Milanese, 2015; Camoli, 1999, MCVE15257), Lombardia (Biraghi, 2016 - A.M.I.N.T.), Friuli Venezia Giulia (Zecchin 2011, MCVE 27175).
, Emilia Romagna (Panchetti, 2004; Angeli, 2009, MCVE24450), Veneto (Milanese, 2015; Camoli, 1999, MCVE15257), Lombardia (Biraghi, 2016 - A.M.I.N.T.), Friuli Venezia Giulia (Zecchin 2011, MCVE 27175).
Ringraziamenti
Gli autori esprimono un sentito ringraziamento a Gabriele Cacialli (Livorno), Claudio Angelini (Porcia, PN) e a Enrico Bizio (Cannaregio, VE) per l’invio di importante materiale bibliografico. Un ringraziamento particolare va a Giovanni Consiglio (Casalecchio di Reno BO), per la rilettura critica del testo.
BIBLIOGRAFIA
ALESSIO C.L. – 1982: Collybia xanthophylla Mal. et Bert.: fungo raro, di controversa sistemazione tassonomica. Micologia Italiana 2: 15-21.
ANGELI P. & M. TULLII – 2011: Callistosporium donadinii. Società Veneziana di Micologia. Scheda n° 1137.
ANTONÍN V., M. BERAN, D. DVOŘÁK, J. HOLEC – 2009: First records of Callistosporium pinicola in the Czech Republic and new findings on its ecology. Czech Mycol. 61(1):1-12.
BAS. C., M.E. NOORDELOOS, T.W. KUYPER & E.C. VELLINGA – 1996: Flora Agaricina Neerlandica, Ed. A.A. Balkema, Rotterdam 3: 104.
BERKELEY M.J. & M.A. CURTIS – 1859: Centuries of North American Fungi. The Annals and Magazine of Natural Hystory. London 4: 286.
BIZIO E. – 1990: Callistosporium olivascens. Società Veneziana di Micologia. Scheda n°192.
BIZIO E. – 1991: Primi appunti sulla flora micologica di un’isola della laguna di Venezia. Rivista di Micologia (1): 30-43.
BIZIO E. – 2012: Uno sguardo ai funghi che si affacciano al mare II parte. Bollettino del Centro Micologico Friulano. Udine: 16-17.
BOCCARDO F., M. TRAVERSO, A. VIZZINI & M. ZOTTI – 2013: Funghi d’Italia. Zanichelli, Bologna.
BON M. – 1976: Tricholomes de France et d'Europe occidentale - 4 - Partie descriptive. Documents Mycologiques. Tome VI, fasc. 22-23: 279-286.
BON M. – 1984: Tricholomes de France et d’Europe occidentale. Lechvalier: 285.
BON M. – 1990: Taxons nouveaux et validations. Documents Mycologiques 20(79): 57.
BON M. – 1991: Flore mycologique d’Europe 2, Les tricholomes et ressemblants, Documents Mycologiques, Mémoire Hors 2: 94-95.
CACIALLI G. & V. CAROTI – 2005: Prodromo alla flora fungina della provincia di Livorno. Supplemento n 1 al Vol. 18 (2005) dei quaderni del museo di storia naturale di Livorno – Provincia di Livorno: 10.
CACIALLI G., V. CAROTI & F. DOVERI – 1995: Funghi fimicoli e rari o interessanti del litorale toscano – Schede di Micologia, Vol. 1. A.M.B. Fondazione Centro Studi Micologici. Brescia.
CETTO B. – 1994: I funghi dal vero, Vol. 4. Edizioni Saturnia – Trento, n. 1476.
CETTO B. – 1994: I funghi dal vero, Vol. 6. Edizioni Saturnia – Trento, n. 2417.
CETTO B. – 1994: I funghi dal vero, Vol. 7. Edizioni Saturnia – Trento, n. 2778.
CONSIGLIO G. & C. PAPETTI – 2001: Atlante fotografico dei Funghi d’Italia, Vol. 2. A.M.B. – Trento: 603.
CONTU M. – 1993: Funghi della Sardegna: note e descrizioni - I. - Micologia Italiana 22(1): 55-47.
EYSSARTIER G. & P. ROUX - 2011: Le guide des champignons France et Europe. Éditions Belin.
GALLINARI A. & G. GILIANI – 2007: Censimento della micoflora del Colle Sant’Anna (Provincia di Brescia, Italia Settentrionale). Natura Bresciana 35: 35-52.
HALAMA M. & R. RUTKOWSKI – 2014: Callistosporium pinicola (Basidiomycota), a fungus species new to Poland. Acta Mycologica 49 (2):189-197.
JANČOVIČOVÁ S., D. SENKO & V. KUČERA – 2016: What do we know about the Callistosporium collections from Slovakia?. Thaiszia - J. Bot., Košice 26 (1):27-40.
LANZONI G. – 1986: Raccolte interessanti del 1984. Bollettino del Gruppo Micologico Bresadola (1-2): 81-90.
LAVORATO C., A. VIZZINI, Z.-W. GE & M. CONTU – 2015: Redescription of Clitocybe umbrinopurpurascens (Basidiomycota, Agaricales) and revision of Neohygrophorus and Pseudoomphalina. Phytotaxa 219 (1): 043-057.
MALENÇON G. & R. BERTAULT – 1975: Flore des champignons superieurs du Maroc. Tome II – Rabat: 402-406.
MATHENY P.B., J. M. CURTIS, V. HOFSTETTER, M.C. AIME, J.M. MONCALVO, Z.W. GE, Z.L. YANG, J.C. SLOT, J.F. AMMIRATI, T.J. BARONI, N.L. BOUGHER, K.W. HUGHES, D.J. LODGE, R.W. KERRIGAN, M.T. SEIDL, D.K. AANEM, M.D. NITIS, G.M. DANIELE, D.E. DESJARDIN, B.R. KROPP, L.L. NORVELL, A. PARKER, E.C. VELLINGA, R. VILGALYS, D.S. HIBBETT – 2006: Major clades of Agaricales: a multilocus phylogenetic overview. Mycologia 98(6): 982–995.
MILANESE V. – 2015: Un fungo lignicolo di ambiente temperato. Qui Saccardo 41: 10-11.
MONTI G., M. MARCHETTI, L. GORRERI & P. FRANCHI – 2001: Funghi di ambienti dunali. Grafiche 2000 – Pisa: 31.
MOSER M. – 1978: Die Röhrlinge und Blätterpilze (Polyporales, Boletales, Agaricales, Russulales). Gustav Fischer Verlag – Stuttgart. New York.
MOSER M. – 1986a: Guida alla determinazione dei funghi. Saturnia – Trento 1: 135.
MOSER M. – 1986b: Notes on the genus Callistosporium. Atti Convegno Intern. Micol. "La famiglia delle Tricholomataceae". 10-15 Sett. 1984, Centro Studi Flora Mediterranea 6: 145-159.
NONIS U. – 2009: 500 funghi. Priuli & Verlucca – Torino: 224-225.
PANCHETTI M. – 2004: Due macromiceti interessanti delle pinete costiere ravennati. Pagine di Micologia. Centro Studi Micologici 21: 79-82.
PAPETTI C. & C. ZOVADELLI – 2016: La nostra partecipazione al 74° Comitato Scientifico Nazionale dell’A.M.B. a Piombino. Rivista di Micologia 59 (2): 129-150.
PERCO B. – 1988: Descrizione completa di un fungo molto raro C. olivascens Bon var. aerinum (Quél.) Bon. Bollettino AMER 15: 4-10.
REDHEAD S.A. – 1982: The systematics of Callistosporium luteo-olivaceum. Sydowia 35: 223-235.
ROMAGNESI H. & R. KÜHNER – 1953: Flore Analytique des Champignons Supérieurs 157.
ROMAGNESI H. & R. KÜHNER – 1954: Compléments a la Flore Analytique: III. Especes nouvelles, critiques ou rares de Pleurotacées, Marasmiacées et Tricholomacées. Bulletin de la Société des Naturalistes d'Oyonnax 8: 71-131.
SACCARDO P.A. – 1925: Sylloge Fungorum, Vol. XXIII: 45.
SABA M. & A.N. KHALID – 2014: First report of Callistosporium luteoolivaceum from Western Himalaya, Pakistan. Mycotaxon 129 (1): 73-77.
SÁNCHEZ-GARZÍA M., P.B. MATHENY, G. PALFNER & D.J. LODGE – 2014: Deconstructing the Tricholomataceae (Agaricales) and introduction of the new genera Albomagister, Corneriella, Pogonoloma and Pseudotricholoma. Taxon 63(5): 993-1007.
SINGER R. – 1944: New Genera of Fungi. Mycologia. Mycological Society of America 36(4): 363-364.
SINGER R. – 1970: Omphalinae (Clitocybeae-Tricholomataceae, Basidiomycetes). Flora Neotropica Monograph. Haftner Publishing Company – New York and London 3: 47-50.
SINGER R. – 1977: Keys for the identification of the species of Agaricales I. Sydowia 30(1-6): 262-263.
SINGER R. – 1986: The Agaricales in Modern Taxonomy, 4th Ed. - Koeltz Scientific Books.
VELLINGA E.C. – 1988: Glossary. In: Flora Agaricina Neerlandica 1 (eds. BAS C., KUYPER TH. W., NOORDELOOS M.E. & VELLINGA E.C.), Balkema, Rotterdam: 54-64.
VERBEKEN A., R. WALLEYN: 2003 - Validation de Callitosporium xanthophyllum fo. minor et de Xerula radicata fo. arrhiza. Documents Mycologiques 32(127-128):3-7.
VESTERHOLT J. & J. HOLEC – 2008: Funga Nordica: agaricoid, boletoid and cyphelloid genera – Copenhagen: 449-450.
ZUCCHERELI A., G. PEZZI & M. MELANDRI – 2001: Funghi di Romagna: il comprensorio ravennate. Checklist. Quaderno di Studi e Notizie di Storia Naturale della Romagna 14: 47.
SITI INTERNET
AGOSTINELLI L. – 2010: Callistosporium olivascens. Gruppo Micologico Naturalistico Ancona, accessibile da http://www.gruppomic...article&id=127>, consultato in data 1.11.16.
A.M.I.N.T. – 2016: Callistosporium xanthophyllum. Associazione Micologica e Botanica, accessibile da http://www.funghiita...showtopic=26017, consultato in data 1.11.2016
DE RUVO B. – 2010: Funghi Teramani. Ritrovamenti di funghi della Provincia di Teramo, accessibile da http://funghiteraman...inger-1946.html, consultato in data 1.11.16.
DI PALMA F. – 2016: Callistosporium olivascens var. aerinum. Forum A.M.I.N.T. Associazione Micologica e Botanica accessibile da http://www.funghiita...showtopic=88167, consultato il 1.11.16.
INDEX FUNGORUM database: accessibile da http://www.indexfungorum.org., consultato in data 9 febbraio 2016.
MYKOBANK database, accessibile da http://www.mycobank.org., consultato il 9.2.16
ZUGNA M. – 2004: Callistosporium olivascens. A.M.B. Forum di Micologia, Gruppo di Muggia e del Carso, accessibile da http://www.ambmuggia...ium-olivascens/, consultato il 1.11.16



 Questa discussione è bloccata
Questa discussione è bloccata