Notulae su una bella Inocybe dalle lamelle giallo-aranciate: Inocybe flocculosa var. crocifolia
Paolo Picciola
Via d’Alviano 86, 34144 Trieste paolo.picciola@libero.it
Marino Zugna
Località Riostorto 7, 34015 Muggia marinozugna@gmail.com
Introduzione
Vengono descritte e commentate alcune raccolte di Inocybe flocculosa var. crocifolia: una singolare entità contraddistinta da inusuali cromatismi lamellari che evocano quelli del Cortinarius croceus.
Le raccolte sono state effettuate in ambiente urbano, ai margini di un boschetto d’impianto composto da carpino nero.
Materiali e Metodi
La descrizione dei caratteri macroscopici è stata ricavata analizzando i basidiomi freschi fotografati in situ con l’ausilio di una fotocamera Reflex NIKON D90. Lo studio microscopico è stato condotto sia su esemplari freschi che essiccati, questi ultimi preventivamente idratati in KOH 2%. Le misure microscopiche sono state eseguite con il software di calcolo Mycométre gentilmente fornitoci dal Sig. Georges Fannechère e prelevabile a questo indirizzo http://mycolim.free.fr. Le misure sporali si riferiscono a 100 unità, effettuate in proiezione laterale senza tener conto dell’apiculo, ottenute da sporata o prelevate da altre zone non imeniali, scartando spore ancora evidentemente immature. Per le rimanenti tipologie cellulari si sono eseguite un minimo di venti misure a tipologia. Le misure sottolineate si riferiscono alle medie. Per la terminologia riguardante la tipologia delle caratteristiche macro e microscopiche, si fa riferimento a Else C. Vellinga(1998). Per quanto riguarda la nomenclatura aggiornata ed i nomi degli Autori, abbiamo fatto riferimento a http://www.indexfungorum.org e http://www.mycobank.org.
Le foto concernenti la microscopia, sono state eseguite con l’ausilio di una fotocamera Reflex EOS 50D, posto sul terzo occhio di un microscopio biologico Optech Biostar B5, supportato da ottiche Plan-APO, illuminazione alogena 12V-50 W a luce riflessa, con regolatore d'intensità. Gli exsiccata sono conservati nell'erbario A.M.B. - Gruppo di Muggia e del Carso.
Inocybe flocculosa var. crocifolia (Herink) Kuyper
Persoonia Supplement 3: 163 (1986)
Basionimo = Inocybe crocifolia Herink, Ceská Mykologie 8 (3): 123 (1954)
Sinonimi = Inocybe croceifolia Beller, Doc. Mycol.: 57 (1976)
= Inocybe aurantiifolia Beller, Doc. Mycol.: 26 (1979)
= Inocybe flocculosa f. crocifolia (Herink) Esteve-Rav. & A. Ortega, Mycotaxon 54: 251 (1995)
Sistematica: Inocybaceae, Agaricales, Agaricomycetidae, Agaricomycetes, Agaricomycotina, Basidiomycota, Fungi
Descrizione delle raccolte
Pileo 12-22(23) mm, spesso 2 mm, inizialmente conico-convesso, poi piano-convesso, infine disteso, con umbone poco distinto a sommità ottusa, margine inflesso, non rimoso, in alcuni basidiomi recante residui araneiformi biancastri della cortina; superficie fibrillosa-squamulosa, lanosa-feltrata, di colore brunastro-fulvo uniforme, bruno-ocraceo, nei vecchi esemplari emergono delle tinte giallastre del fondo.
Lamelle strettamente adnate, rettilinee o leggermente ventricose, larghe 3 mm, piuttosto fitte, intercalate da 1-3 lamellule di diversa lunghezza, inizialmente vistosamente giallo-aranciate, poi giallo cadmio, infine ocracee; tagliente indistintamente fimbriato, da biancastro a concolore.
Stipite 11-32 x 3-4(6) mm, cilindrico, leggermente clavato, non bulboso, presto fistoloso, base ricoperta da residui cotonosi biancastri del micelio; superficie inizialmente con tinte giallo-aranciate, che si accentuano con la manipolazione, poi giallastre, infine interamente biancastre, ricoperta per tutta la lunghezza da una fitta feltratura o fioccosità biancastra.
Carne sottile, inizialmente giallo-aranciata, poi giallo-ocracea, infine ocra-grigiastra, traslucida a tempo umido, tendente a decolorare soprattutto nella parte inferiore del gambo; odore debole, subspermatico, sapore mite.
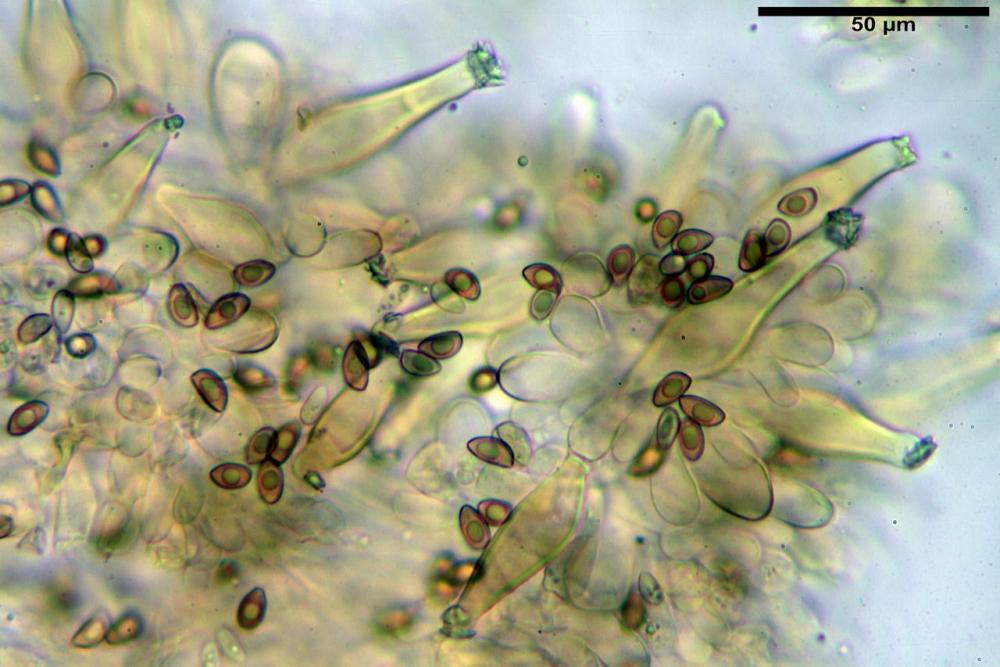
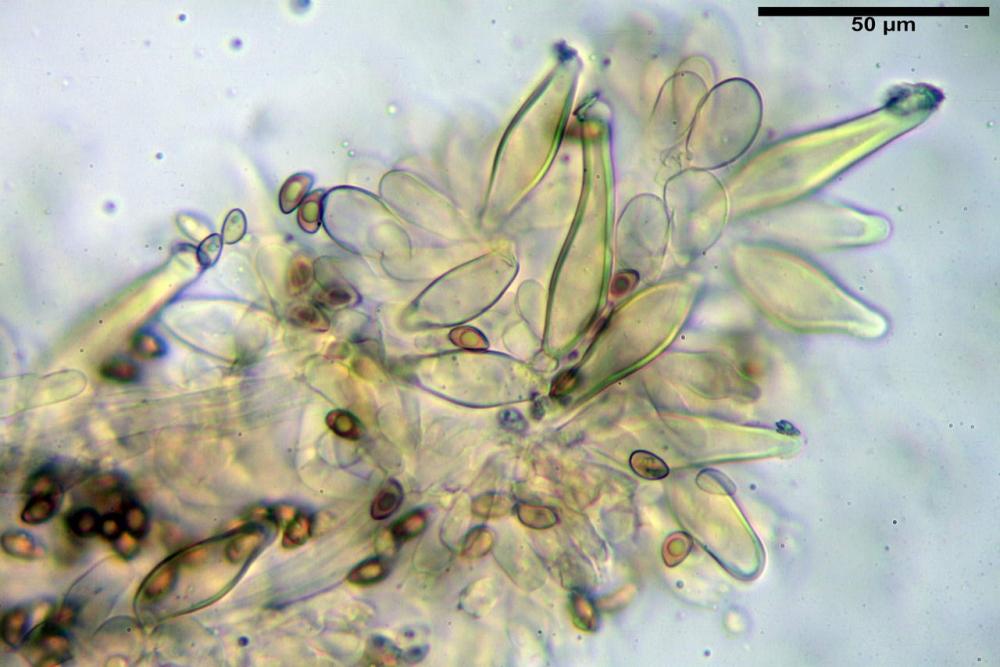
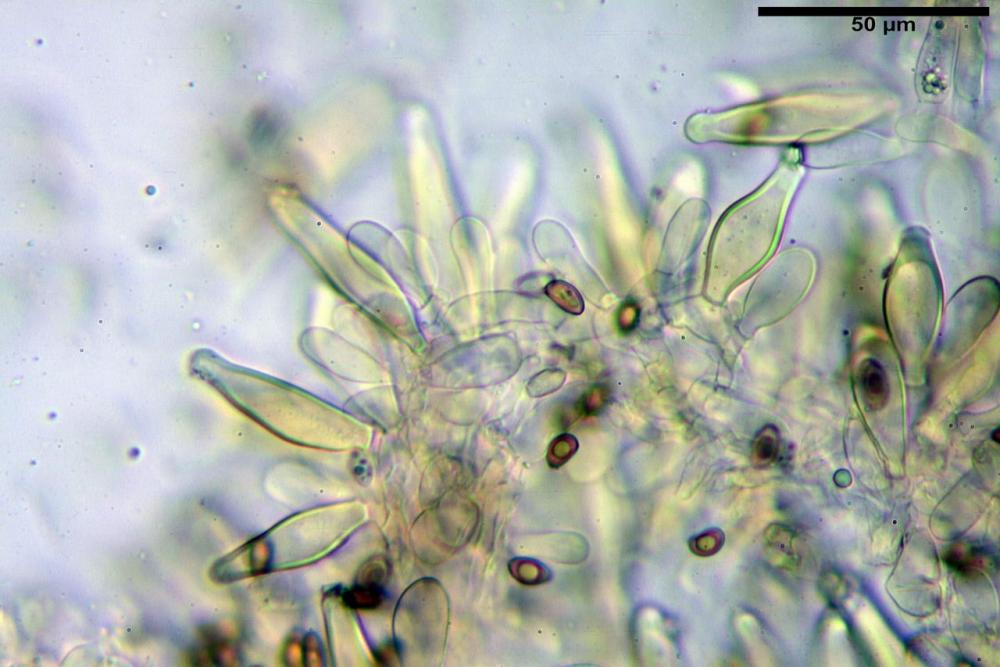
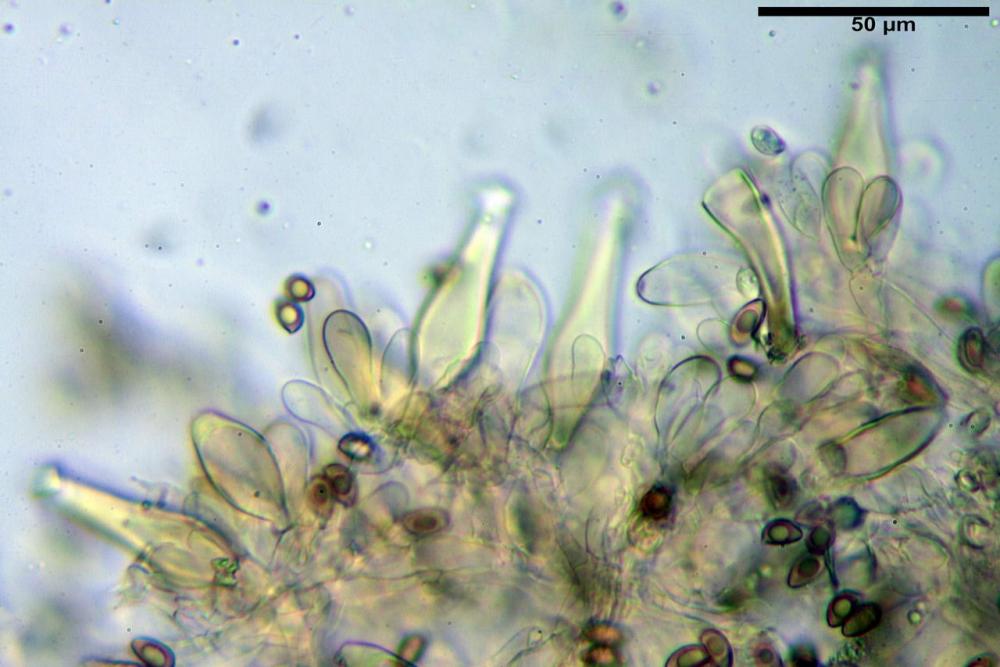
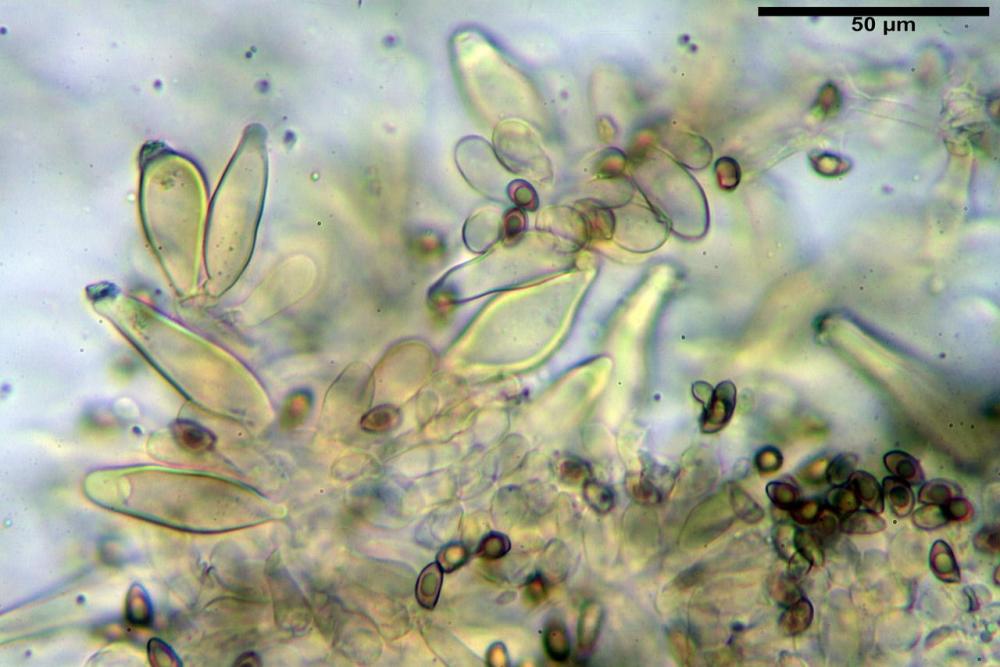
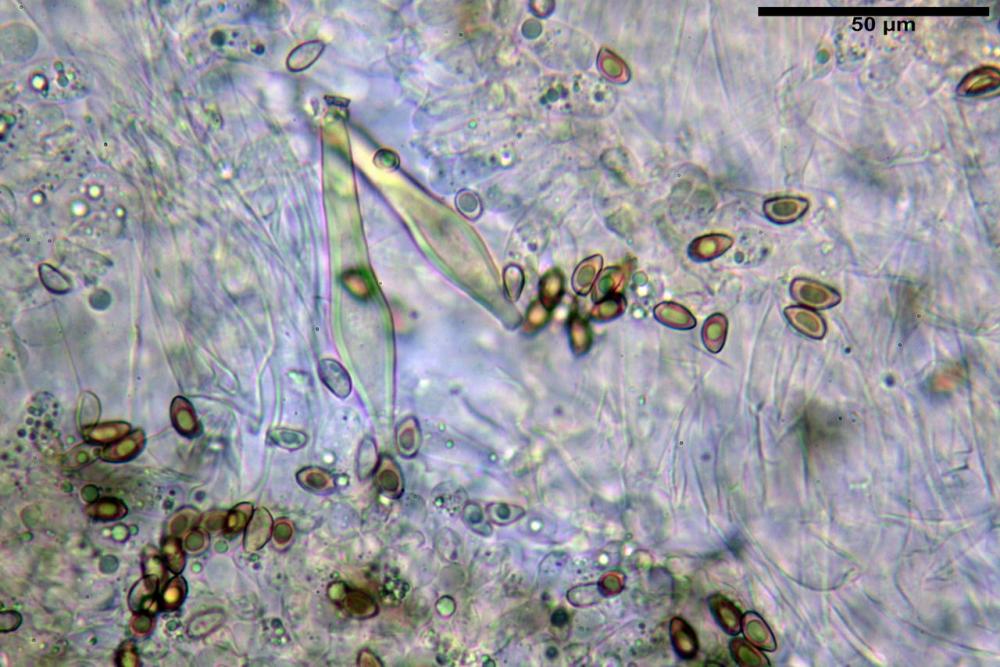
Quadro microscopico
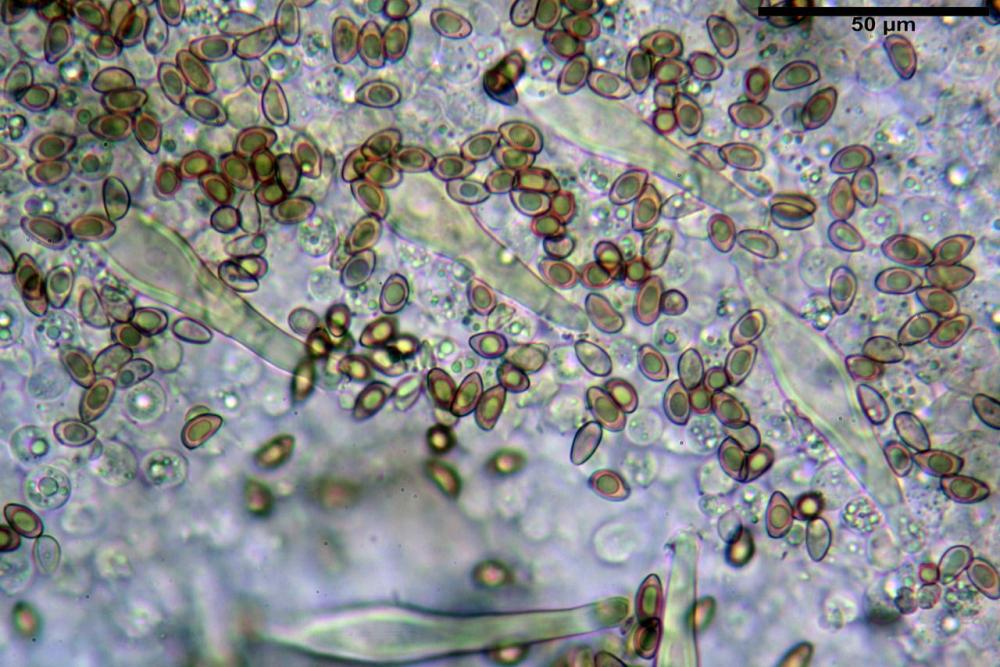
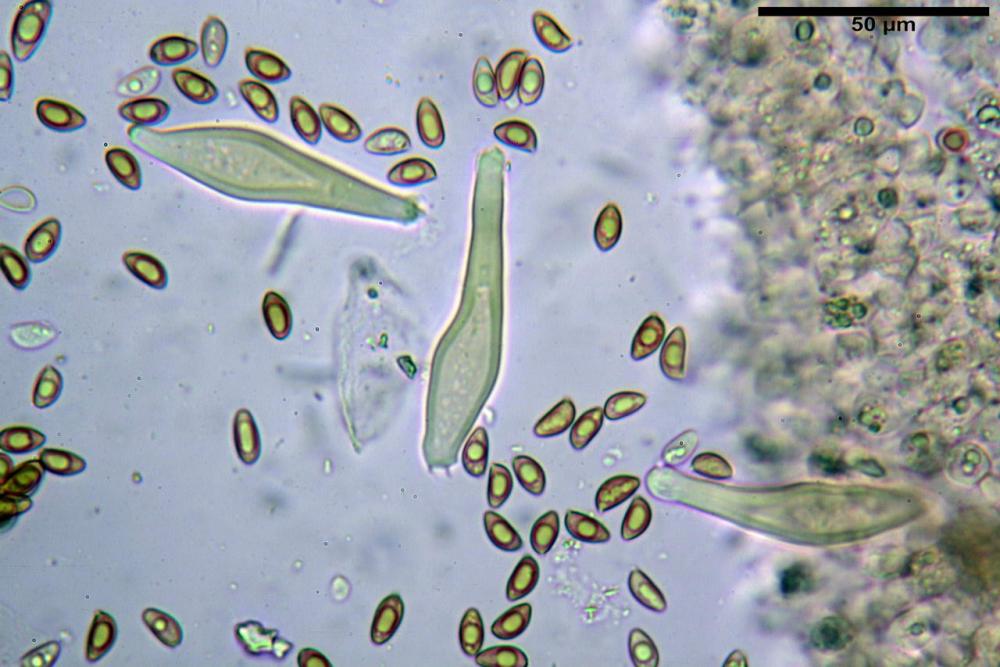
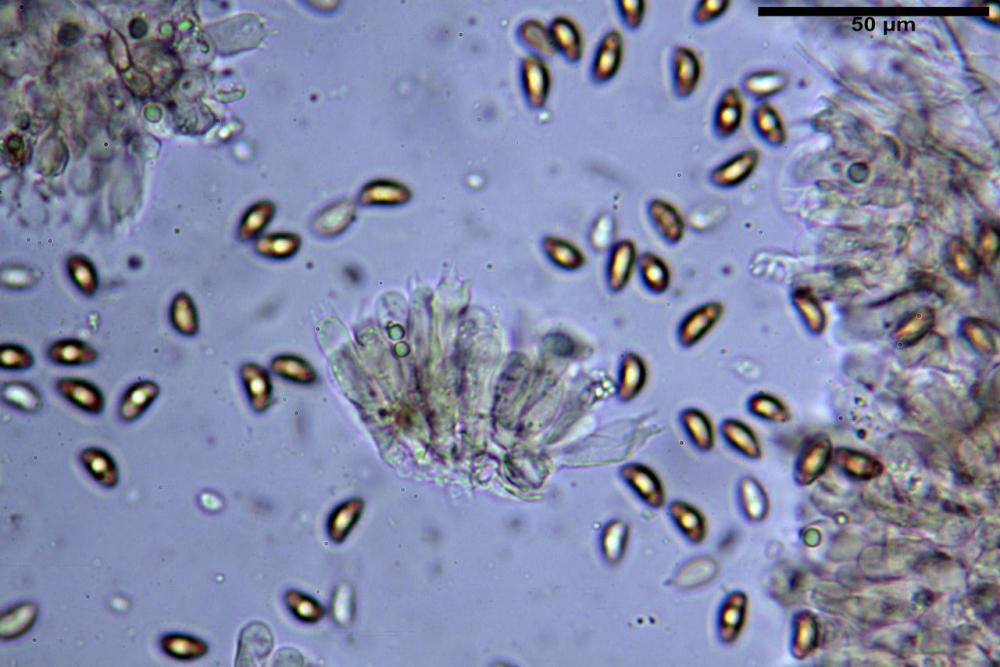
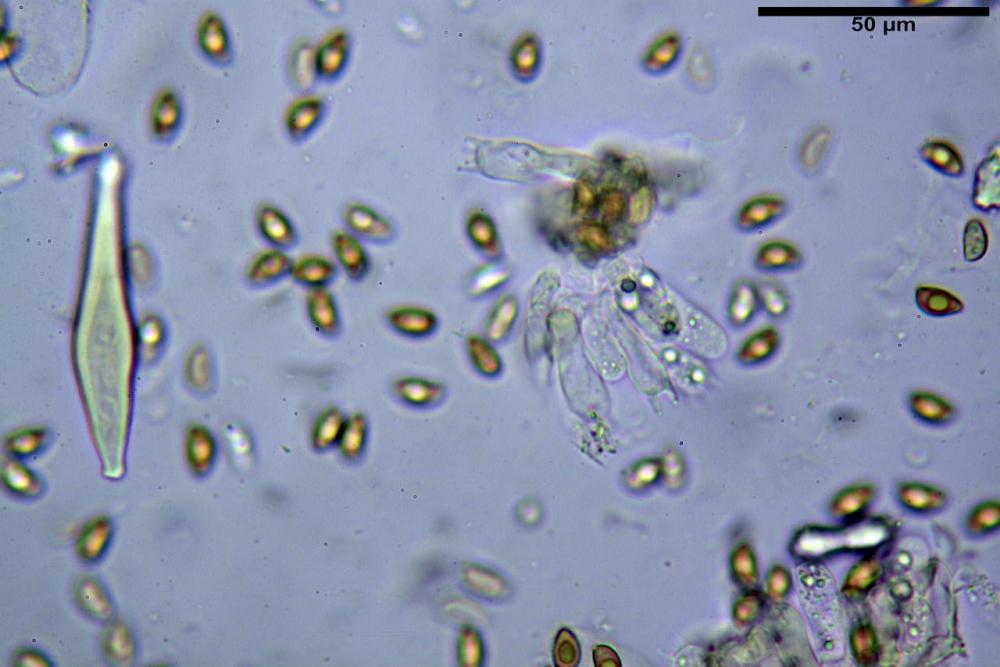
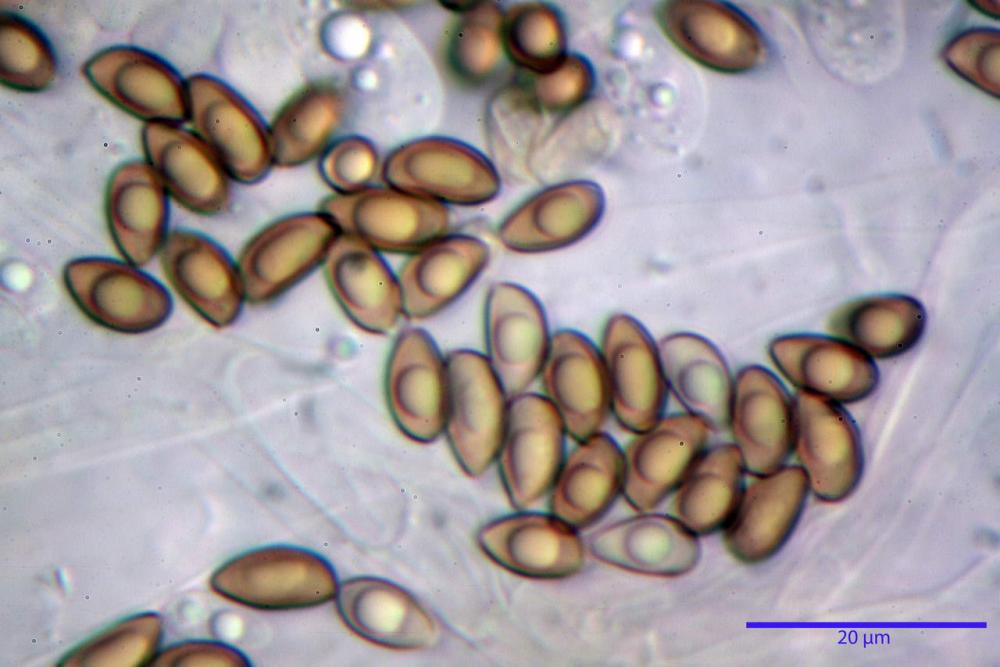
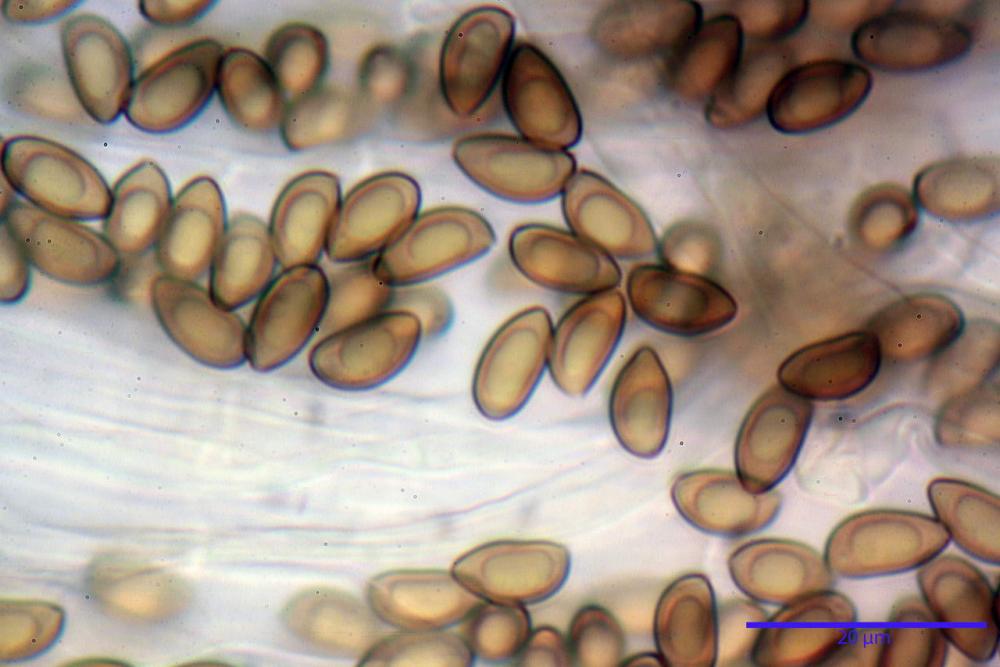
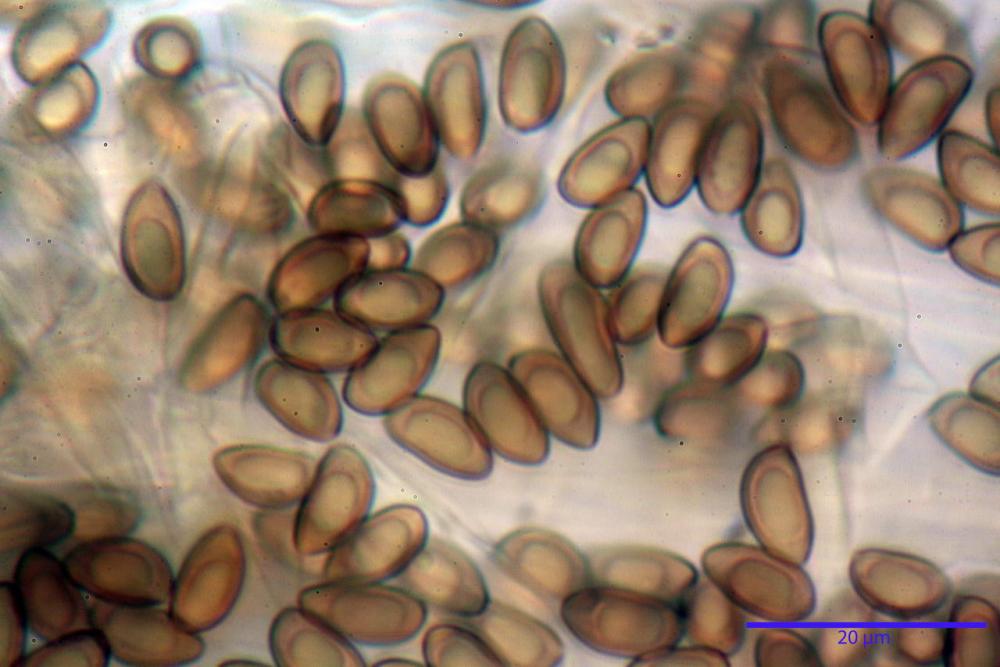
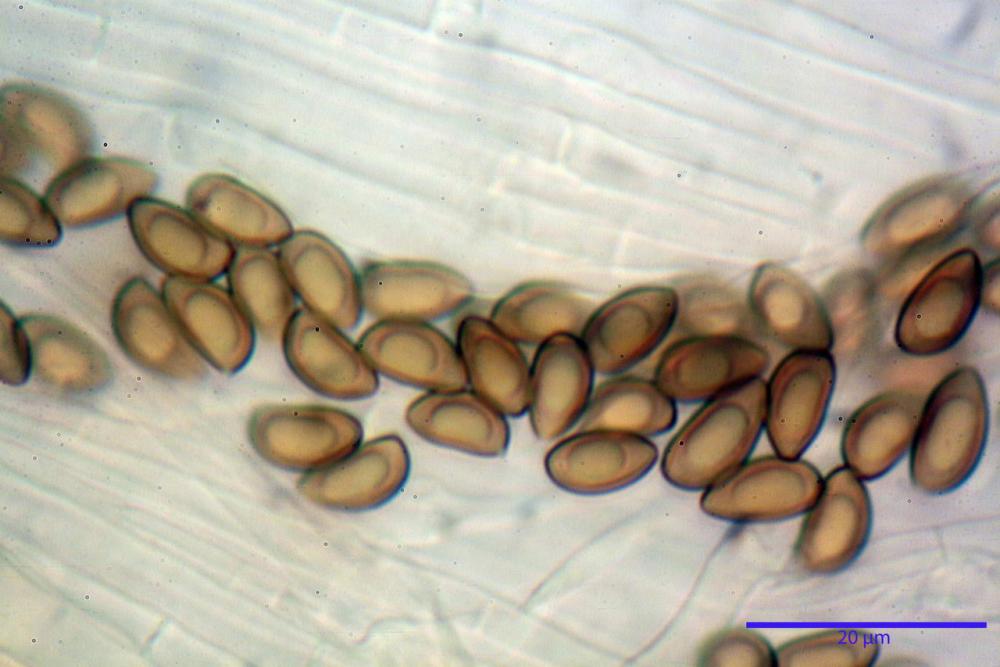
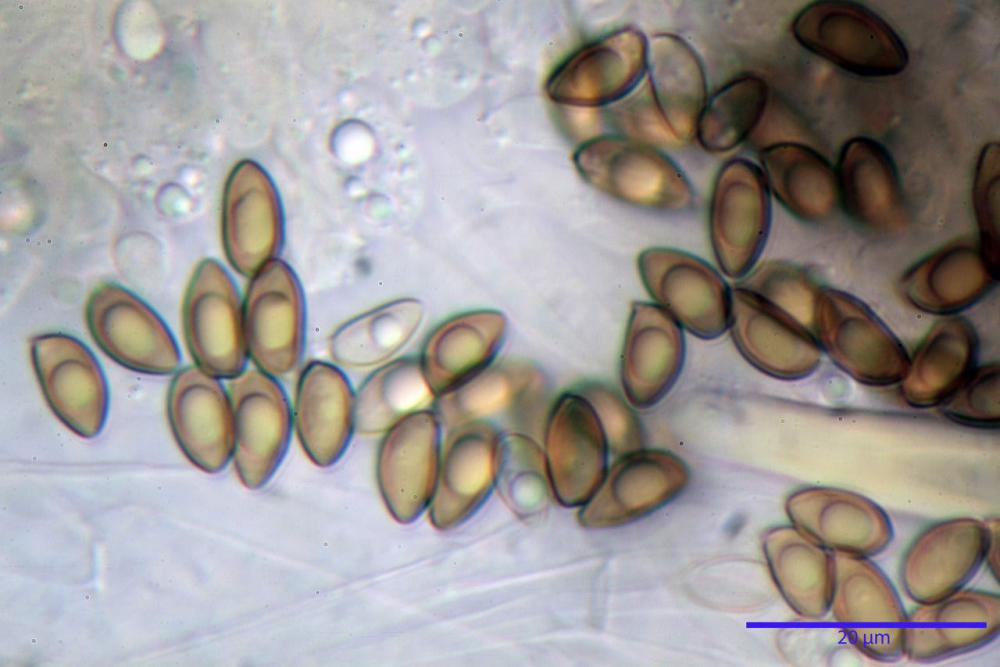
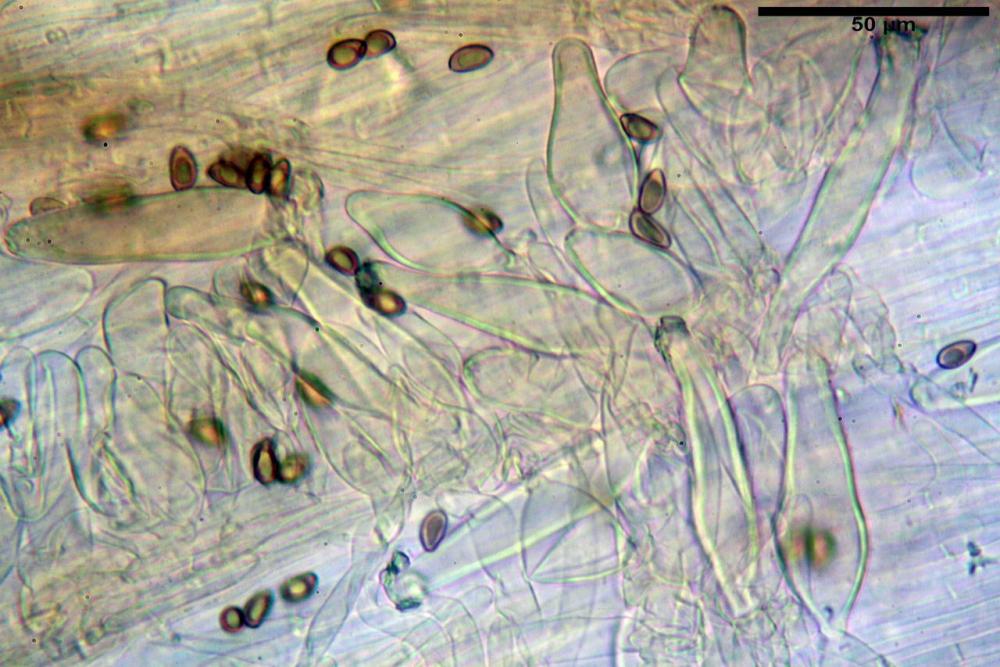
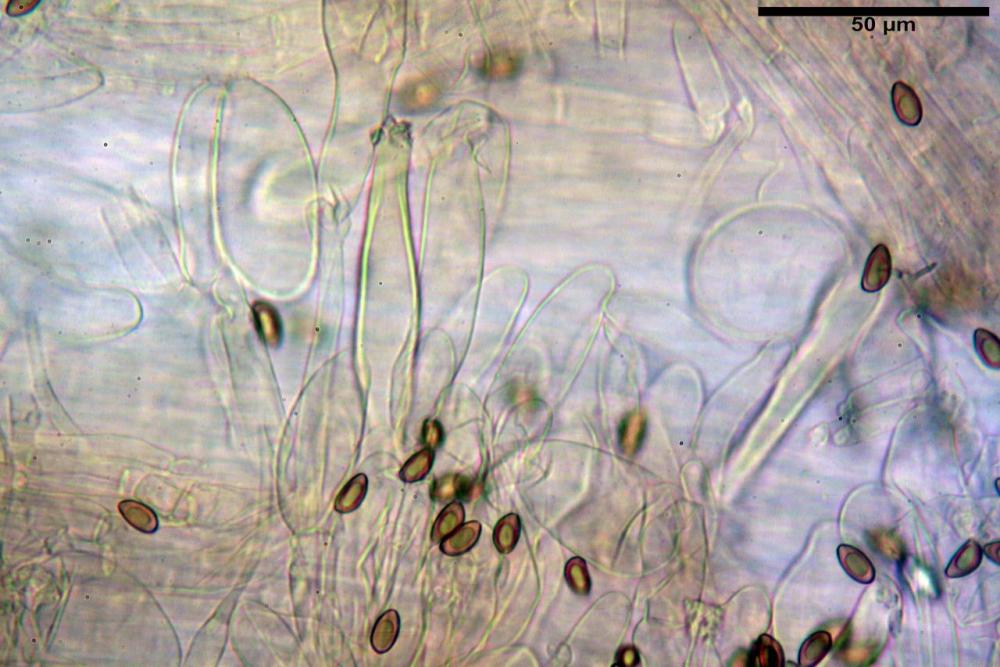
Spore (8,47) 9,35-9,83-10,76 (11,59) x (4,80) 5,01-5,33-5,63 (6,06) µm, Q. = (1,64) 1,74-1,88-2,04 (2,12), Vol. = (115) 127-146-170(218) µm3, subamigdaliformi in visione laterale, ellissoidi in visione frontale, apice subogivale, contenenti un’ampia guttula centrale, lisce, giallo-ocracee in acqua, apiculo poco evidente, ialino.
Basidi (22,0) 22,6-24,5-27,1 (28,2) x (7,1) 7,1-8,3-9,2 (9,4) µm, Q. = (2,3) 2,7-3,0-3,4 (3,8), Vol. = (648) 688-916-1089 (1194) µm3, da claviformi a subcilindrici, tetrasporici.
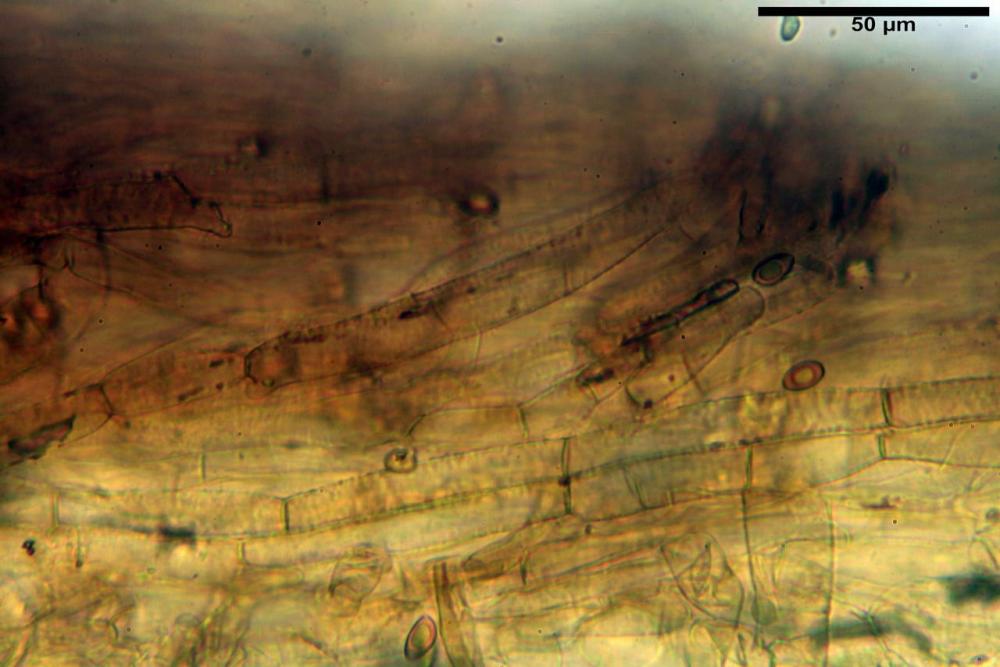
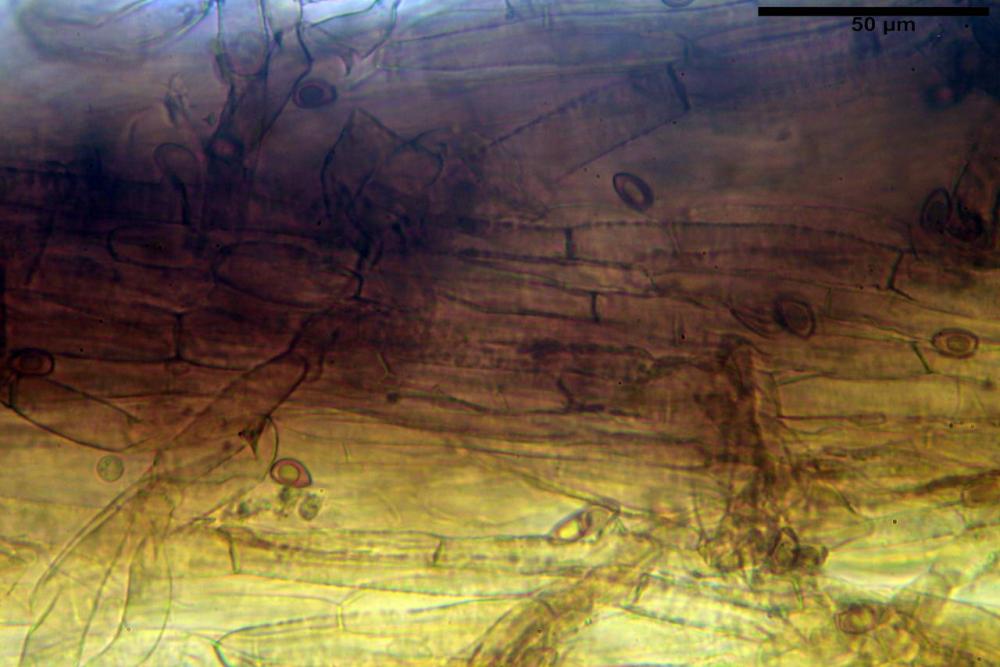
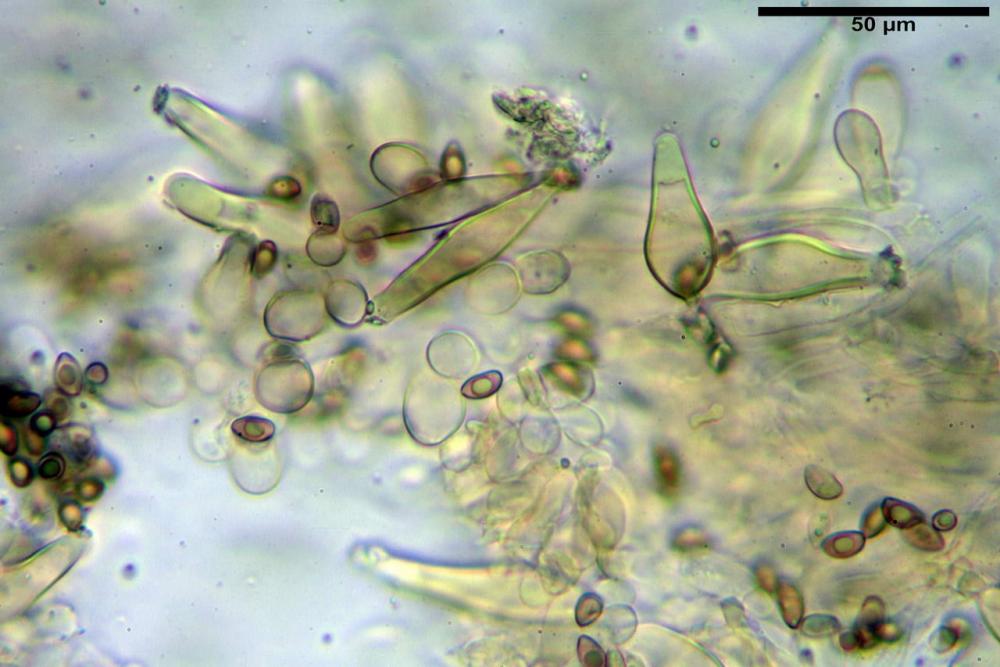
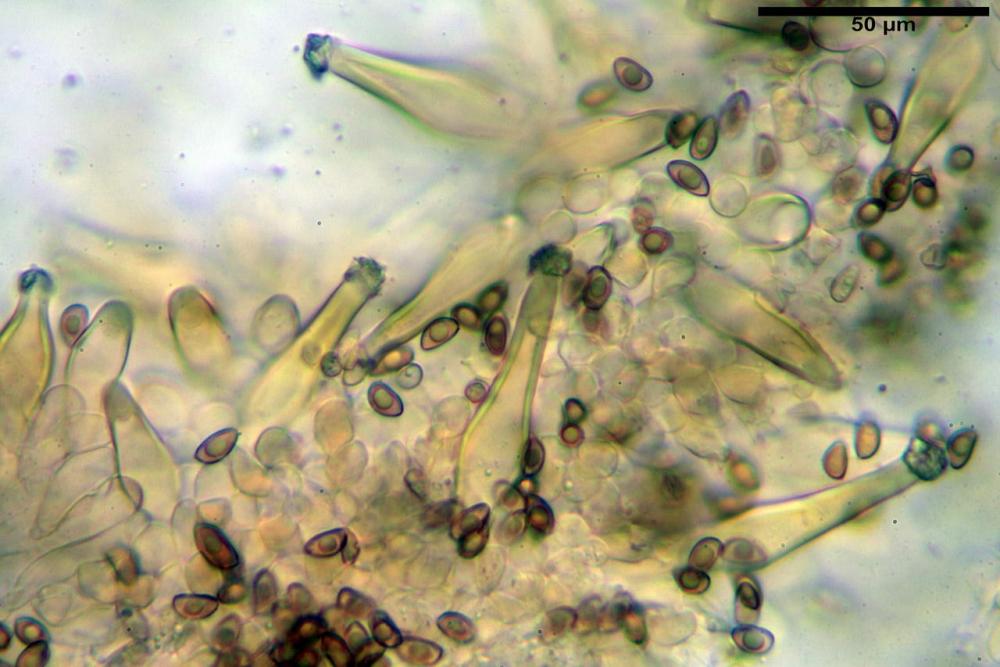
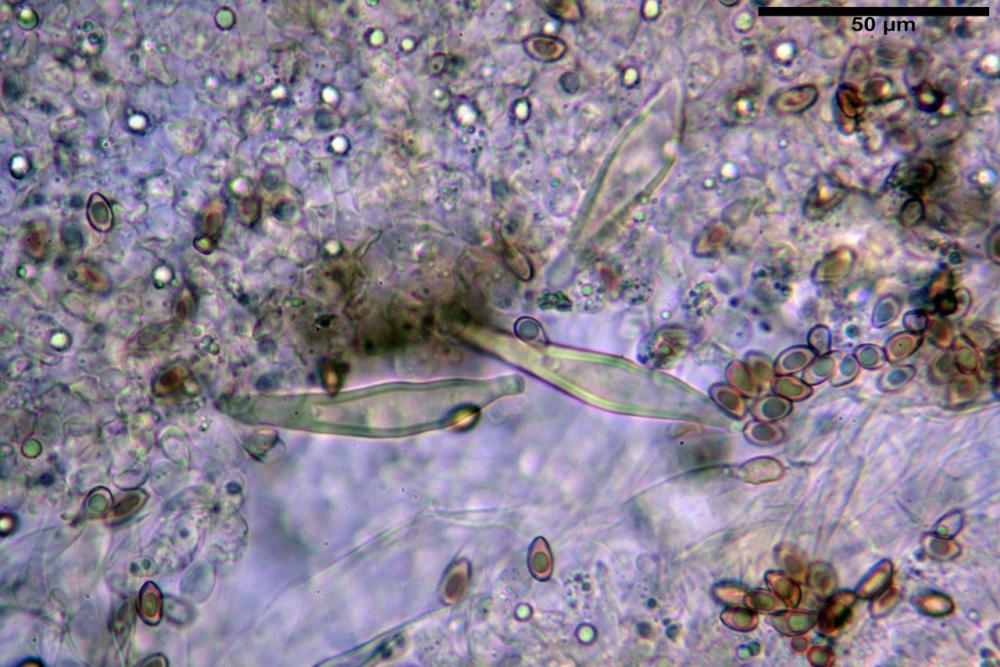
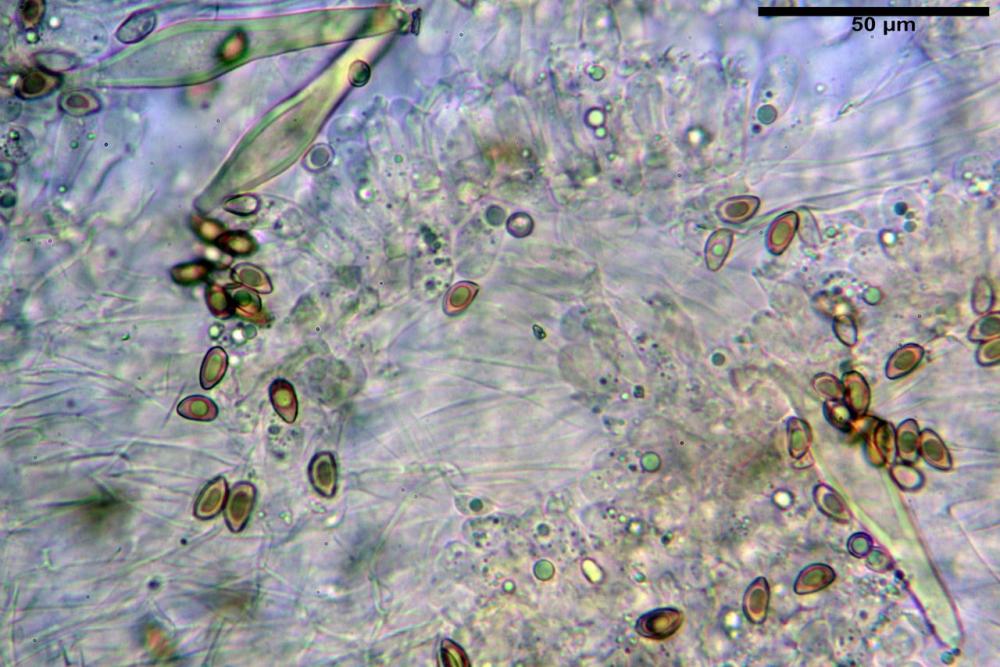
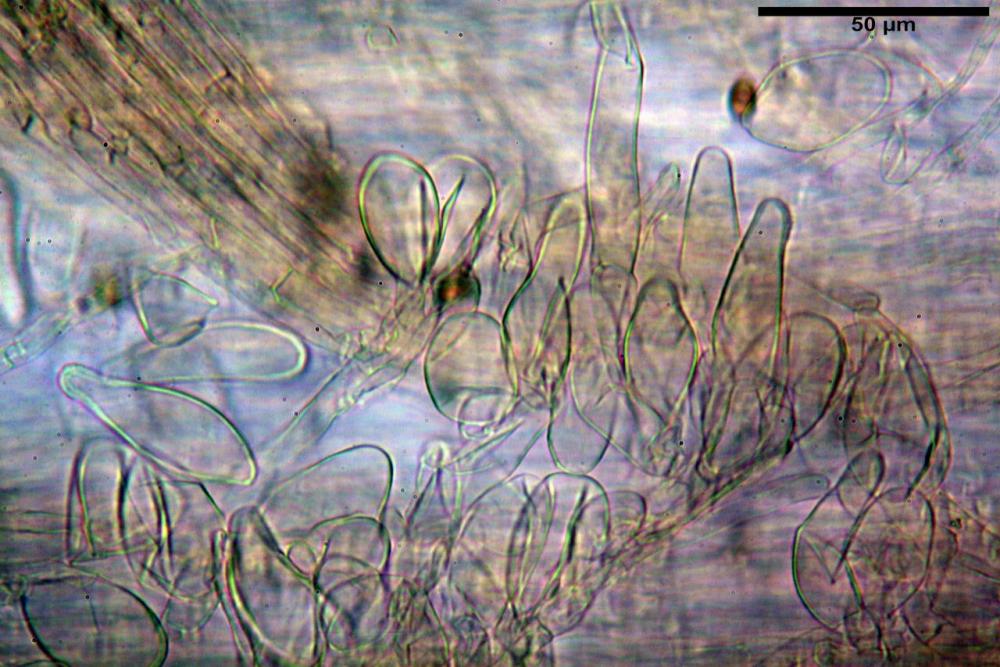
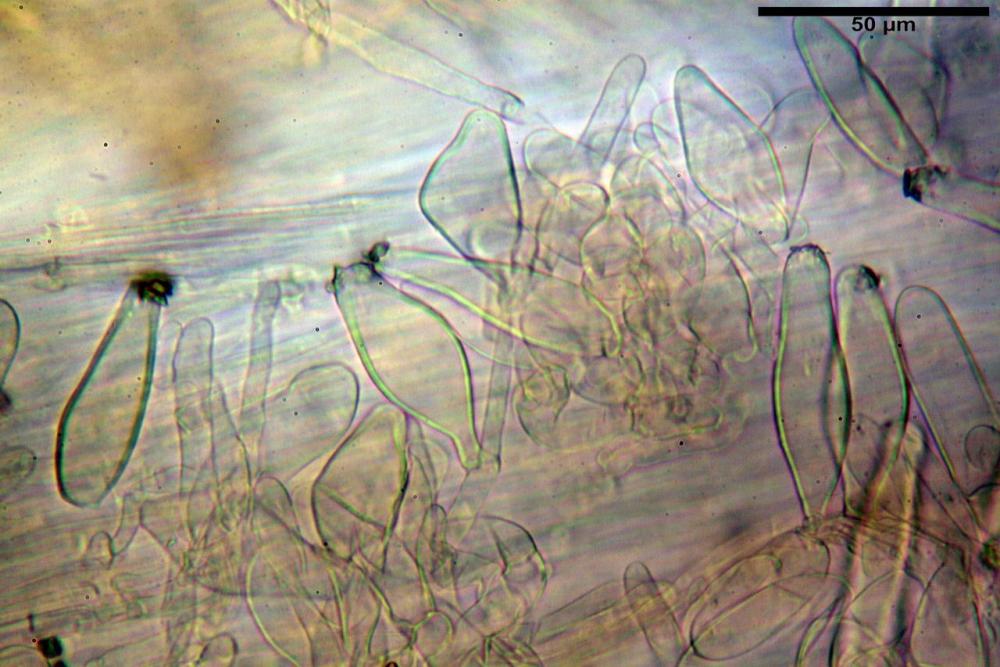
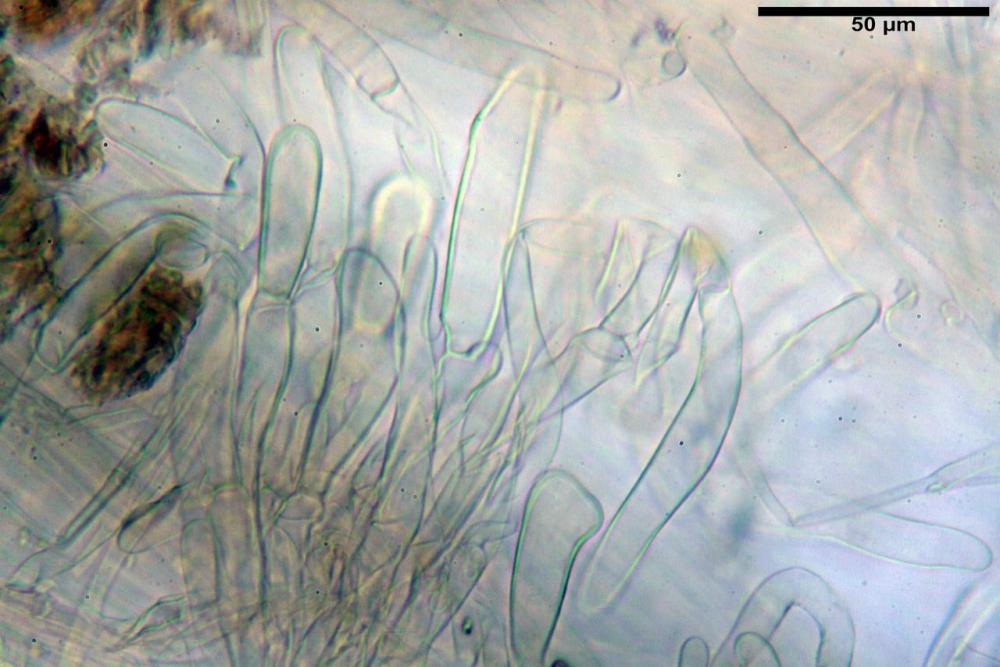
Cheilocistidi riconducibili per lo più a due tipologie distinte, la prima da strettamente lageniforme a strettamente fusiforme (33,8) 36,4-46,0-65,5 (66,7) x (8,4)10,1-13,2-14,4(15,4) µm, Q. = (2,6) 2,8-4,0-5,1 (5,6), Vol. = (1795) 2187-4127-6086 (7736) µm3, solitamente con apice ricoperto da pochi cristalli di Ossalato di Calcio, in alcuni casi avvolto da una sostanza mucosa o nudi, mediamente abbondanti; la seconda (meno abbondanti), da strettamente a largamente utriforme (28,8) 30,9-38,2-42,1 (43,4) x (10,0) 10,5-11,2-16,3 (18,8) µm, Q. = (1,6) 2,2-2,8-3,4 (3,7), Vol. = (1527) 2176-3203-5307 (6089) µm3, in quelli con collo tozzo l’apice è scarsamente muricato e spesso nudo. In entrambe le tipologie la parete risulta mediamente spessa (1,31)1,47-2,15-2,83(2,85) µm, mediamente reattiva (verde-giallastro) con KOH 2%.
Paracheilocistidi (17,1) 18,6-22,3-25,0 (28,1) x (6,7) 7,4-8,7-12,7 (14,3) µm, Q. = (1,5) 1,7-2,8 (3,3), Vol. = (539) 604-2045 (2329) µm3, claviformi, più o meno peduncolati o piriformi, a parete sottile, non reattiva al KOH 2%, frammisti ai cheilocistidi, molto numerosi su tutto il filo lamellare.
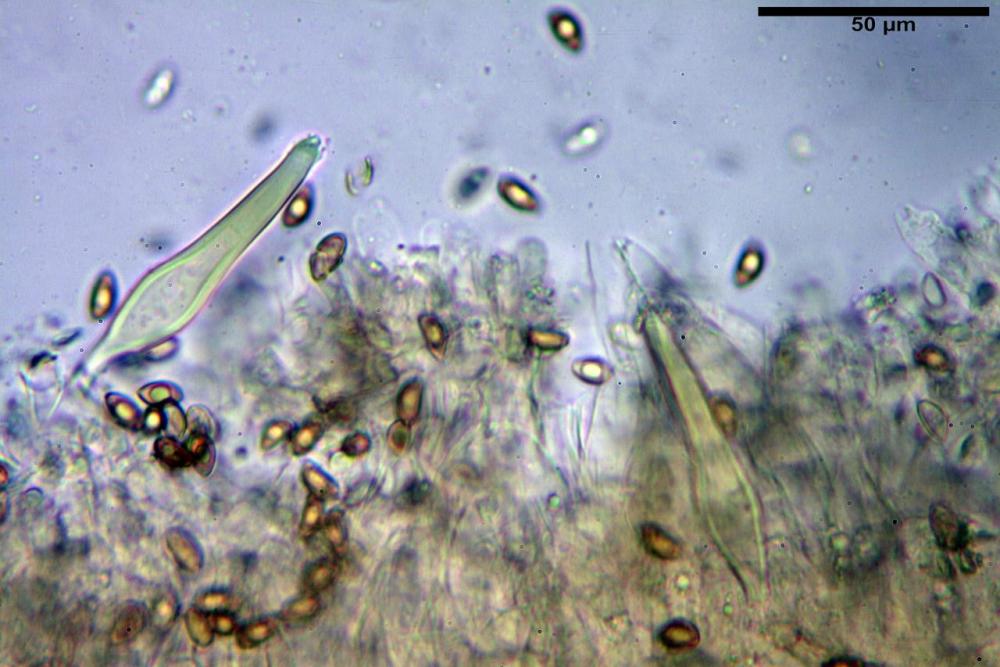
Pleurocistidi (53,8) 62,1-70,1-77,8 (91,3) x (10,9) 11,5-13,6-15,9 (16,9) µm, Q. = (4,2) 4,2-5,5-6,1 (6,6), Vol. = (4359) 4539-7484-9439 (10705) µm3, strettamente lageniformi, molto slanciati, parete spessa (2,5) 2,59-3,6-3,9 (4,0) µm, mediamente reattiva (verde-giallastro) con KOH 2%, abbastanza numerosi.
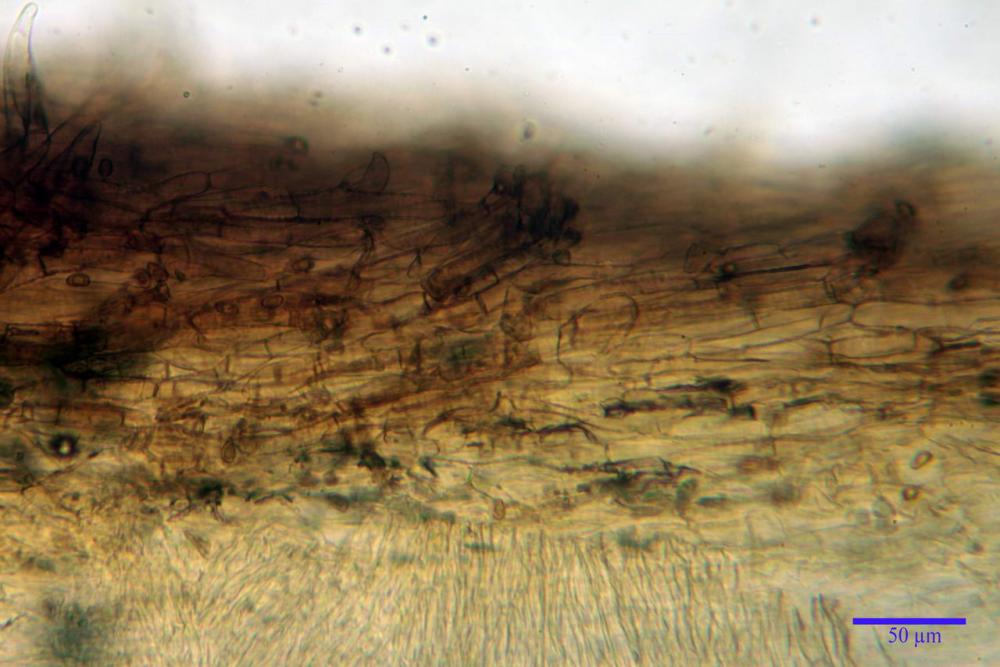
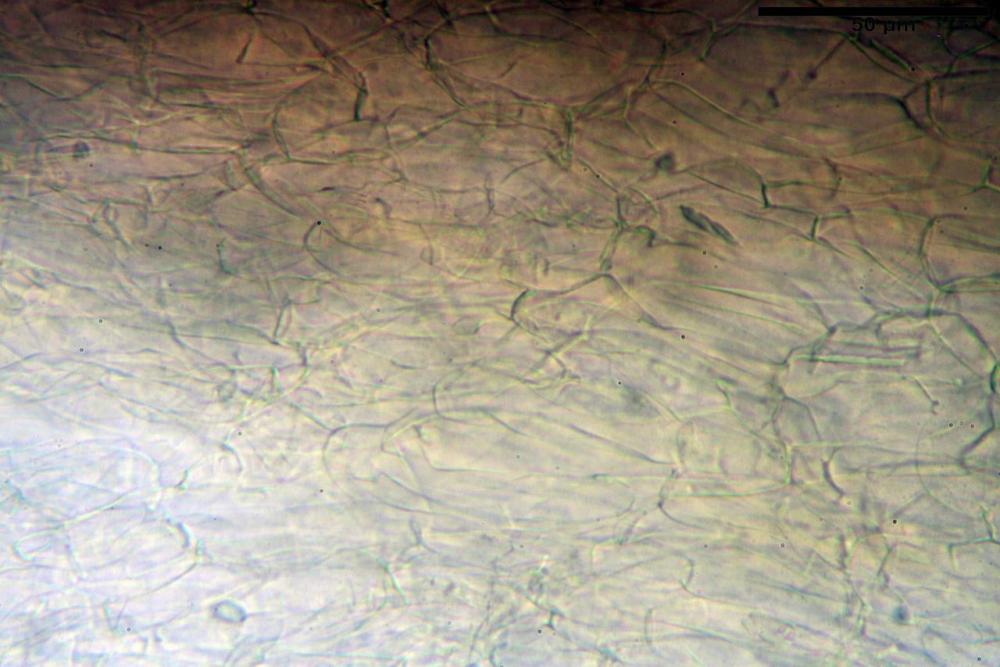
Pileipellis disposta in una cutis, formata da ife settate, larghe (5,2) 5,9-7,9-11,3 (12,7) µm, fortemente incrostate, pigmentate di bruno-giallastro. Subpellis composta da ife allantoidi (9,3) 10,7-14,4-17,0 (18,1) µm, ialine.
Caulopellis disposta in una cutis, formata da ife settate, larghe (4,2) 4,6-6,1-8,0 (10,0) µm.
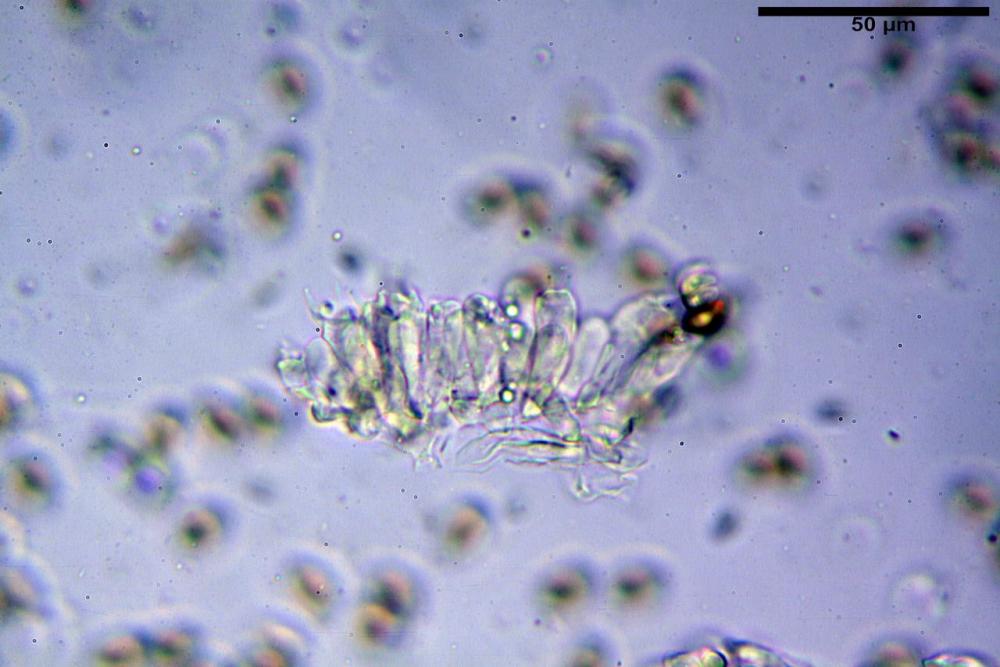
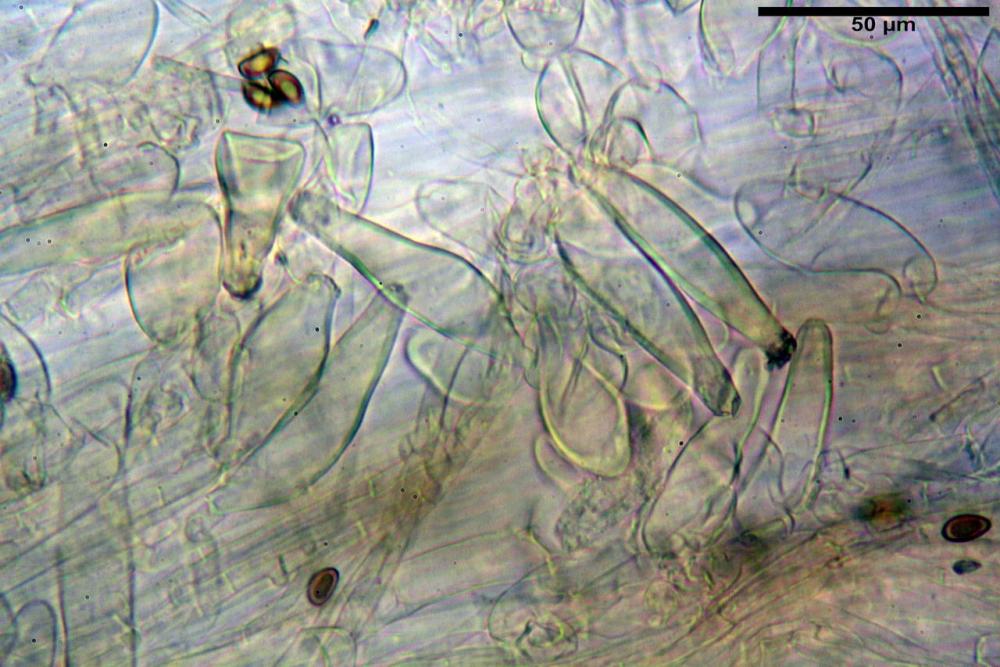
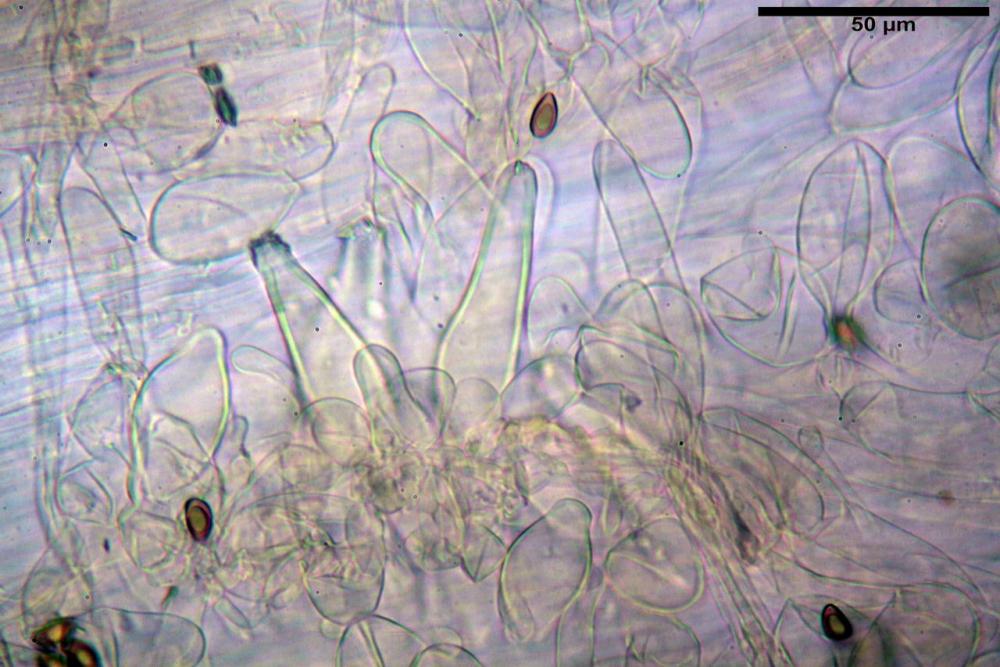
Caulocistidi (33,3) 38,7-62,2-68,7 (81,2) x (11,6) 12,4-16,1-19,7 (22,0) µm, Q. = (1,9) 2,0-4,0-5,2 (6,9), Vol. (3608) 4844-8080-10381 (12487) µm3, simili ai cheilocistidi, parete spessa 1,5-2 µm, poco o per nulla reattiva con KOH 2%, apice con pochi cristalli di Ossalato di Calcio o nudi, mediamente abbondanti, localizzati all’apice dello stipite, “solo nel primo centimetro”. Nel tratto centrale e inferiore ricoperta da numerosi peli caulocistidioidi, riuniti in ciuffi, piuttosto emergenti, a parete sottile, settati, con articolo terminale di dimensioni (30) 42-77 (85) µm.
Paracaulocistidi (31,0) 32,8-36,2-44,9 (47,4) x (16,3) 16,7-19,9-22,5 (24,1) µm, Q. = (1,5) 1,6-1,7-2,4 (2,4), Vol. = (4766) 5342-6360-11231 (13760) µm3, claviformi, più o meno peduncolati, scarsi, frammisti ai caulocistidi.
Giunti a fibbia presenti in tutti i tessuti investigati.
Materiale studiato ed ambiente delle raccolte ITALIA, F.V.G., Trieste centro. Località: Viale Campi Elisi. Coordinate cartografiche: IGM110_SOCTR144. Altezza 3 m s.l.m. Habitat: in una piccola scarpata posta ai margini di un boschetto d’impianto urbano composto da Ostrya carpinifolia e Ulmus minor, su suolo soffice, smosso. Leg. Picciola. Det. Picciola & Zugna. Raccolte: 3.5.2017 (n° 7068); 4.5.2017 (n° 7069); 5.5.2017 (n° 7106); 8.5.2017 (n° 7107).
Osservazioni
Al momento del ritrovamento questa entità si è fatta subito notare per il cappello feltrato-lanoso con tinte brunastre che contrastavano nettamente con quelle sgargianti giallo-aranciate delle lamelle e per la superficie stipitale ricoperta nei giovani basidiomi da una fitta feltratura che ricopriva parzialmente le colorazioni sottostanti giallo-aranciate.
Di fronte a dei basidiomi dalle colorazioni così inusuali per una Inocybe abbiamo in un primo momento ipotizzato ad una Dermocybe, in particolare al Cortinarius croceus, una specie caratterizzata, nei giovani basidiomi, da lamelle colorate intensamente di giallo e dal rivestimento pileico ricoperto da dense squamule giallo-brunastre.
La successiva analisi microscopica ha velocemente escluso questa ipotesi per la presenza di un quadro micro-morfologico tipico del Genere Inocybe, caratterizzato da spore lisce, subamigdaliformi, con apice subogivale, cheilocistidi metulodi, da strettamente lageniformi a strettamente fusiformi fino a largamente utriformi, le cui pareti si colorano di giallo-verdastro con il KOH 2%, frammisti a paracheilocistidi, a parete sottile, non reattivi al KOH 2%, pleurocistidi più slanciati dei cheilocistidi, caulocistidi localizzati all’apice dello stipite, simili ai cheilocistidi, frammisti a numerosi peli caulocistidiodi.
Secondo KUYPER (1986) questa entità è da ricondurre a una semplice forma di Inocybe flocculosa Berk (Sacc.), da lui considerata una specie piuttosto variabile in particolare per quanto concerne il pigmento lamellare.
Sulla base di questo carattere, l’autore olandese individua tre forme distinte: la var. flocculosa a lamelle inizialmente biancastre, la varietà ferruginea a lamelle da arancio-rossastre a rosso-brunastre e la var. crocifolia a lamelle giallo zafferano, giallo-aranciato. Sempre secondo KUYPER (1986) il quadro microscopico di queste forme risulta pressoché identico.
Il complesso “flocculosa” secondo la sistematica di BON (1997) per le spore lisce e i cistidi metuloidi si colloca nel Sottogenere Inocybe, per la presenza di caulocistidi nel terzo superiore del gambo nella Sezione Tardae Bon, per il cappello feltrato, il gambo bianco più o meno feltroso-lanoso, i cistidi imeniali nettamente gialli con l’ammoniaca accompagnati da numerosi paracistidi nella Sottosezione Gausapatinae Bon.
BON (1997) suddivide la Sottosezione Gausapatinae in numerose entità, le quali, secondo KUYPER (1986), ricadono come sinonimi di un’unica specie.
In Italia questo taxon è stato dettagliatamente descritto da FERRARI (2004; 2006; 2008; 2010) con il nome di Inocybe aurantiifolia Beller, separandolo da altre entità vicine, in linea con il pensiero sistematico proposto da BON (1997).
La forma a lamelle giallo-aranciate di Inocybe flocculosa, sebbene considerata alquanto rara da alcuni autori è stata rinvenuta in diversi ambienti del continente europeo.
KUYPER (1986) la segnala sotto diverse essenze arboree (Picea, Pinus, Fagus, Quercu e Tilia) su suolo calcare, la sua presenza in Olanda è circoscritta a quattro località.
BELLER (1976, 1979) e BON (1979) considerano questa entità, subnomine I. aurantifolia, tendenzialmente termofila ed acicola (presso Cedrus).
Raccolte effettuate in Catalogna da ESTEVE-RAVENTÓS & ORTEGA (1995) hanno invece certificato la sua presenza in ambiente mediterraneo, associata a Cistus e Quercus ilex.
Questi ultimi autori la ritengono, sulla base della loro esperienza, una entità piuttosto comune nel cisteto dove ha la tendenza ad esibire un’ampia variabilità nei colori del cappello e delle lamelle.
In virtù di questa spiccata variabilità, ESTEVE-RAVENTÓS & ORTEGA (1995) considerano il pigmento lamellare un carattere poco affidabile perfino a livello varietale, proponendo una nuova combinazione, Inocybe flocculosa forma crocifolia per quelle raccolte con lamelle a tinte da giallo pallide a giallo intense.
In Italia, questa varietà è stata segnalata da FERRARI in provincia di Novara, presso Alnus, Quercus, Corylus, Robinia (FERRARI, 2004) e in provincia di Cuneo presso latifoglie con predominanza di Castanea sativa (FERRARI, 2008).
Inocybe flocculosa var. crocifolia può essere scambiata con Inocybe lutescens Velen., poiché quest’ultima possiede una tipica colorazione gialla più o meno intensa sul gambo ma soprattutto sulle lamelle.
Inocybe lutescens possiede una cuticola liscia, fibrillosa-rimosa e non tomentosa-feltrata come nel complesso di entità gravitante attorno a Inocybe flocculosa.
Anche in Inocybe lutescens, ALESSIO (1984) ha riscontrato una forte variabilità per quanto concerne l’intensità del pigmento giallo su tutte le parti del carpoforo. Alla luce di quanto esposto riteniamo che i pigmenti lamellari gialli, giallo-aranciati e rosso-aranciati siano da considerare caratteri poco affidabili per delimitare le singole entità all’interno della Sottosezione Gausapatinae Bon.
Bibliografia
ALESSIO C.L. – 1984: Complemento allo studio del genere Inocybe: 5 contributo. Bollettino del Gruppo Micologico Bresadola: 247-258.
BELLER – 1976: Doc. Mycol. 57:
BELLER – 1979: Doc. Mycol. 9(35): 26.
BIZIO E. & G. CONSIGLIO – 2002: Contributo alla conoscenza del genere Inocybe. Bollettino AMER 56(2): 3-54.
BIZIO E. & G. CONSIGLIO – 2005: Contributo alla conoscenza del genere Inocybe – II parte. Bollettino AMER 64/65(1): 48-69.
BOCCARDO F., M. TRAVERSO, A. VIZZINI & M. ZOTTI – 2008: Funghi d’Italia. Zanichelli. Bologna.
BON M. – 1997: Clé monographique du genre Inocybe (Fr.) Fr.(2éme partie): sous-genre Inocybe = Inocybium (Earle) Sing.). Doc. Mycol. 27 (108): 1-77.
BREITENBACH J. & F. KRÄNZLIN – 2000: Champignons à lames 2ème partie. Champignons de Suisse. T. 4. Mycologia. Lucerna.
CHIARI M., G. GILIANI, G. MEDARDI & C. PAPETTI – I funghi della città di Brescia. A.M.B. Circolo Micologico G. Carini. Brescia.
CONSIGLIO G. & C. PAPETTI – 2009: Atlante fotografico dei Funghi d’Italia. Volume 3. A.M.B. Fondazione Centro Studi Micologici. Trento.
ESTEVE-RAVENTÓS F. & A. ORTEGA – 1995: Checklist of the genus Inocybe in Andalusia (Peninsular Spain). Mycotaxon 54:245-261.
ESTEVE-RAVENTÓS F., J. VILA & X. LLIMONA – 2002: Estudios sobre el género Inocybe (Cortinariales) en los jarales de Cataluña. I. Revista Catalana de Micologia. 24:135-145.
FERRARI E. – 2004: Alcune rare Inocybe rinvenute nella Provincia del Verbano-Cusio-Ossola e in zone confinanti. Bollettino dell’Associazione Micologica ed Ecologica Romana (62-63): 33-45.
FERRARI E. – 2006: Inocybe alpine e subalpine. Il genere Inocybe (Fr.) Fr. nel nord Italia e paesi limitrofi. Fungi Non Delineati Raro vel Haud Perspecte et Explorate Descripti aut Definite picti. Pars XXXIV-XXXV-XXXVI. Edizioni Candusso. Alassio
FERRARI E. – 2008: Scheda n. 1090. Inocybe aurantiifolia Beller. Società Veneziana di Micologia.
FERRARI E. – 2010: Inocybe dai litorali alla zona alpina. Fungi Non Delineati Raro vel Haud Perspecte et Explorate Descripti aut Definite picti. Pars LIV-LV. Edizioni Candusso. Alassio.
KUYPER T.W. – 1986: A revision of the genus Inocybe in Europe. I. Subgenus Inosperma and the smooth-spored species of subgenus Inocybe. Persoonia 3 (supplement). Leiden.
ILLESCAS FERREZUELO T. & C. MORENTE DÍAZ – 2016: Inocybe ferruginea Bon, un bello y poco conocido Inocybe. Yesca. Sociedad Micológica Cántabra 28: 97-102.
SACCARDO P.A. –1887: Sylloge Hymenomycetum, Vol. I. Agaricineae. Sylloge Fungorum. 5:1-1146.
SOLAK M. H., H. ALLI, M. IŞILOĞLU & E. KALMIŞ – 2009: Some new records of Inocybe (Fr.) Fr. from Turkey. Tübitak. 33: 65-69.
Sinonimi di Inocybe flocculosa
=Agaricus flocculosus Berk., The English Flora, Fungi 5-2 (2): 97 (1836)
=Inocybe pluteoides Höhn., Sitzungsber. Akad. Wiss. Wien, Math.-Naturwiss. Kl.: 14 (1907)
=Inocybe cordae Velen., Ceske Houby 2: 375 (1920) [MB#261926]
=Inocybe rohlenae Velen., Ceske Houby 2: 379 (1920) [MB#276671]
=Inocybe fulvidula Velen., Novitates mycologicae: 120 (1939) [MB#265530]
=Inocybe dentifera Velen., Novitates mycologicae novissimae: 60 (1947) [MB#287218]
=Inocybe gausapata Kühner, Bulletin de la Société des Naturalistes d'Oyonnax 9 (suppl.): 4 (1955) [MB#282698]
=Inocybe subtigrina Kühner, Bulletin de la Société des Naturalistes d'Oyonnax 9 (suppl.): 6 (1955) [MB#298978]
=Inocybe geraniolens Bon & Beller, Documents Mycologiques 6 (24): 45 (1976) [MB#315842]
=Inocybe ferruginea Bon, Documents Mycologiques 8 (30): 69 (1978) [MB#315835]



 Questa discussione è bloccata
Questa discussione è bloccata