Psathyrella olympiana A.H. Sm., Contr. Univ. Mich. Herb. 5: 36 (1941)
Sinonimi: Psathyrella amstelodamensis Kits van Wav., Persoonia 6(3): 299 (1971)..
Psathyrella olympiana f. amstelodamensis (Kits van Wav.) Kits van Wav., Persoonia, Suppl. 2: 281 (1985).
Psathyrella olympiana f. caespitosa Kits van Wav., Persoonia, Suppl. 2: 282 (1985).
Psathyrella olympiana A.H. Sm., Contr. Univ. Mich. Herb. 5: 36 (1941) f. olympiana.
Sistematica: Psathyrellaceae, Agaricales, Agaricomycetidae, Agaricomycetes, Agaricomycotina, Basidiomycota, Fungi
Descrizione macroscopica
Basidiomi di taglia medio-piccola, carne abbastanza scarsa, igrofani, crescita da solitaria a aggregata, lignicoli.
Pileo fino a 30 mm di diametro all’inizio subsferico, quindi convesso, infine sub-applanato, rugoso-costolato, con umbone ottuso, margine intero o leggermente striato per trasparenza. Cuticola più o meno liscia, di colore brunastro nella porzione discale, beige in periferia, testa di Moro nei primordi, beige negli esemplari adulti. Margine pelosetto. Ricoperta da una fine pruina fioccosa. Velo abbondante, bianco, da fioccoso-pruinoso a radialmente fibrilloso appezzabile sia negli esemplari giovani che negli adulti.
Lamelle ventricose, sinuose, all'inizio grigio-beige, via via più scure, infine marrone-grigiastro, intercalate da 3 (4) lamellule, filo lamellare concolore, da intero a finemente eroso.
Stipite fino a 70 x 3-5 mm, cilindrico, diritto o sinuoso; di colore bianco, con lievi tonalità brunastre dove manipolato o con l’umidità; finemente pruinoso e longitudinalmente striato nella porzione apicale, fibrilloso più in basso. all’inizio pieno, poi fistoloso, Base di uguale spessore o soltanto leggermente ristretta ricoperta da fibrille e squamette bianche o brunicce.
Carne poco consistente, ceracea di colore bruno nel pileo, biancastra-beige e fibrosetta nello stipite.
Odore e sapore erbacei.
Descrizione microscopica
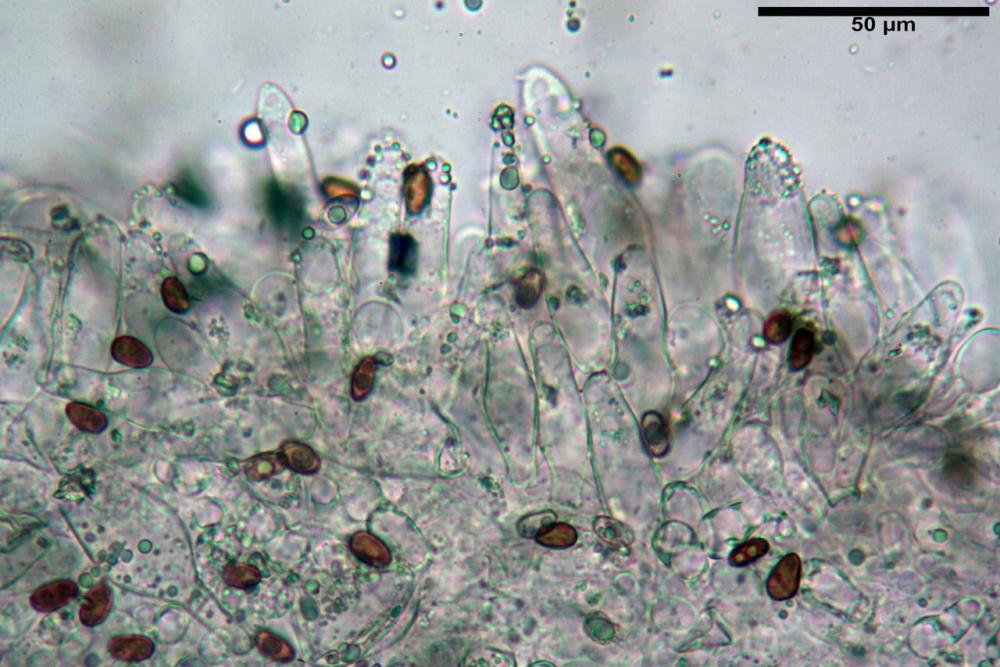
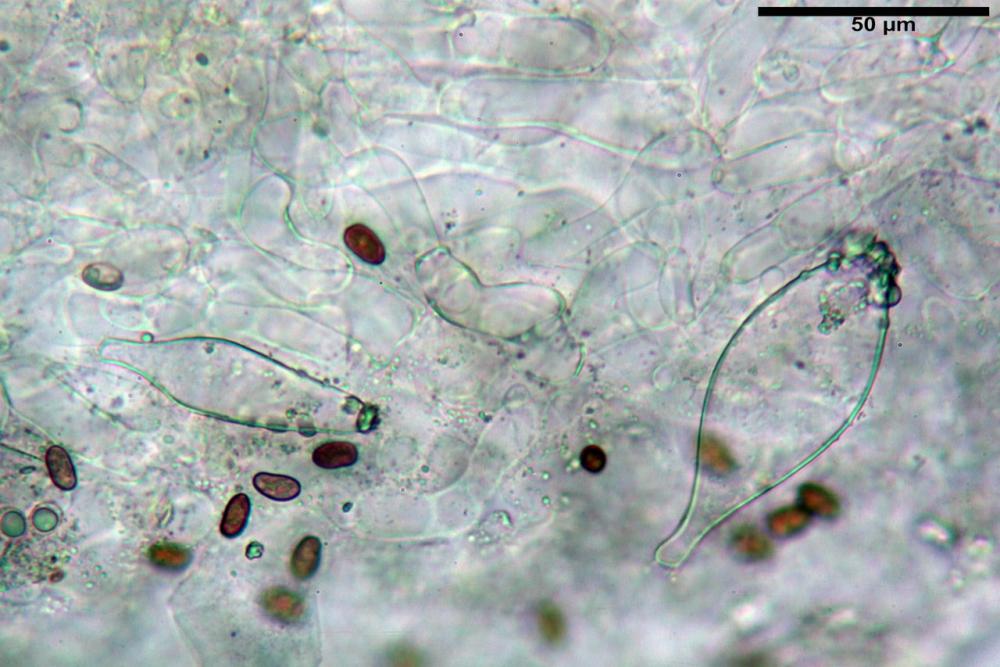
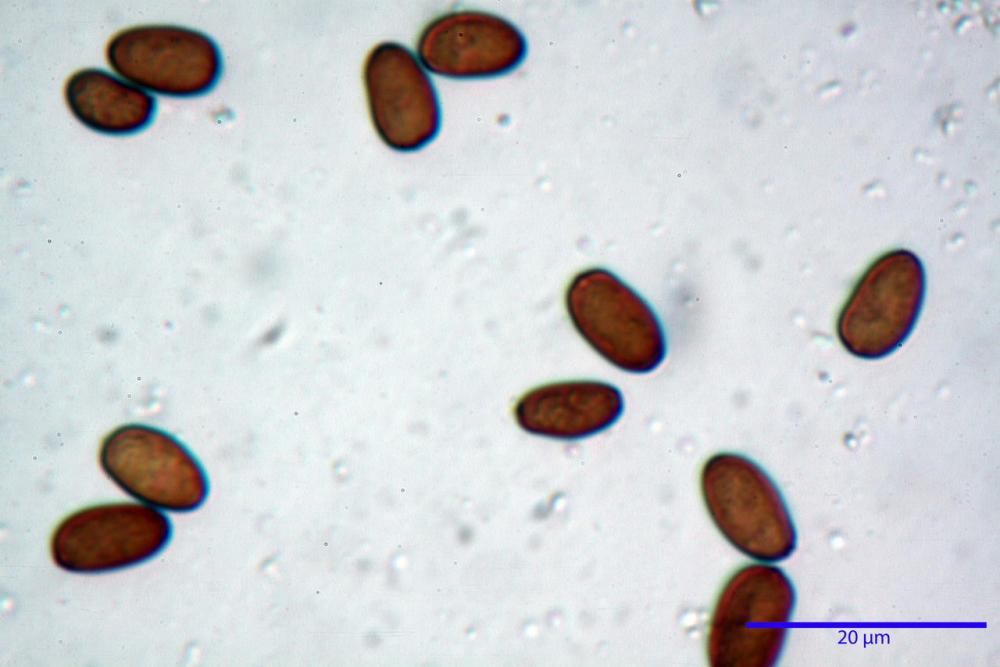
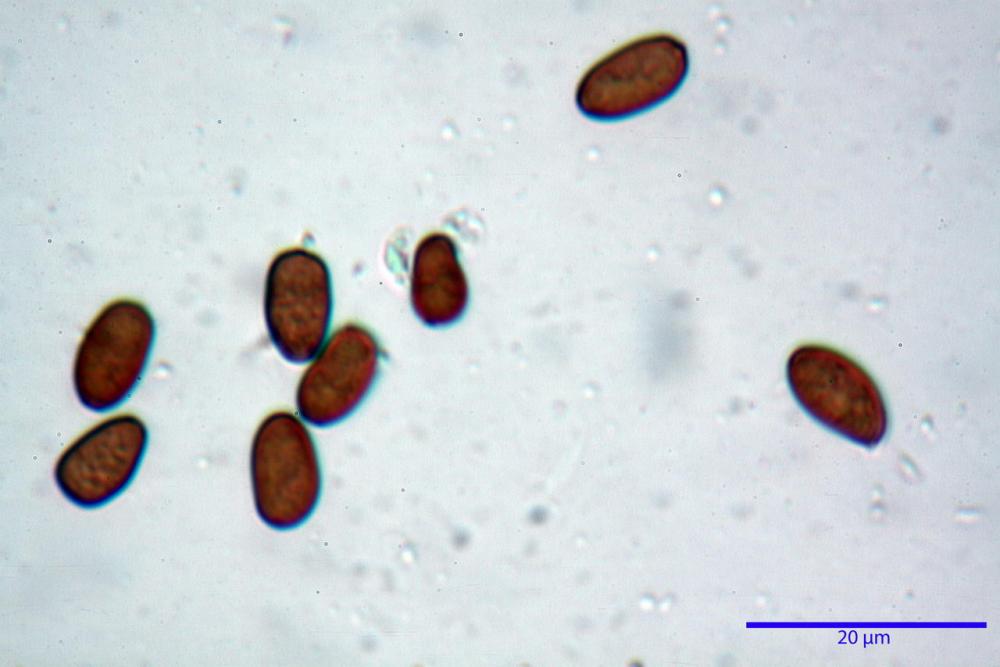
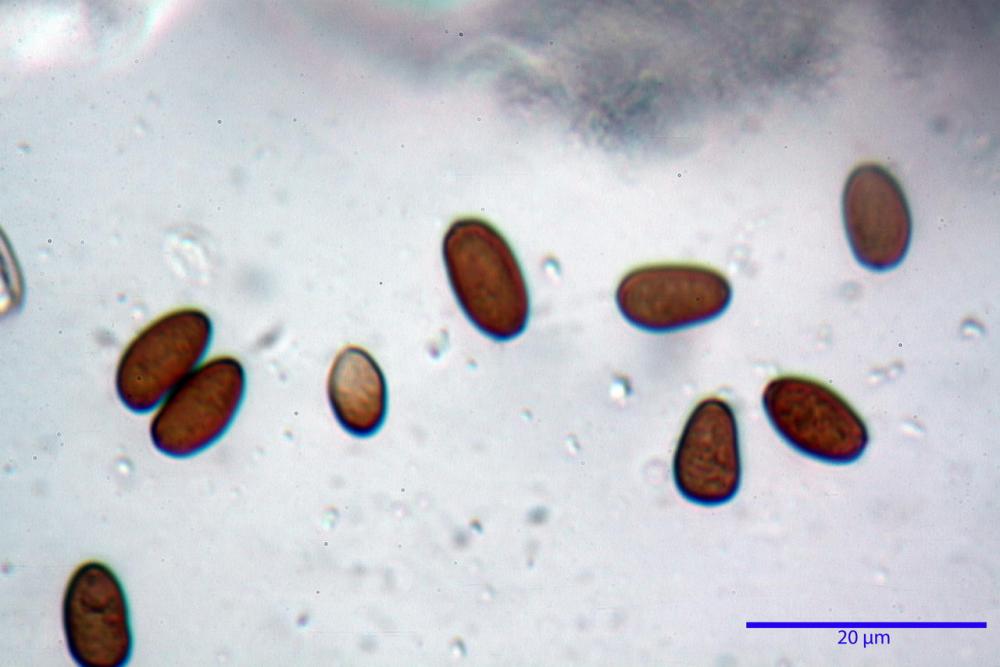
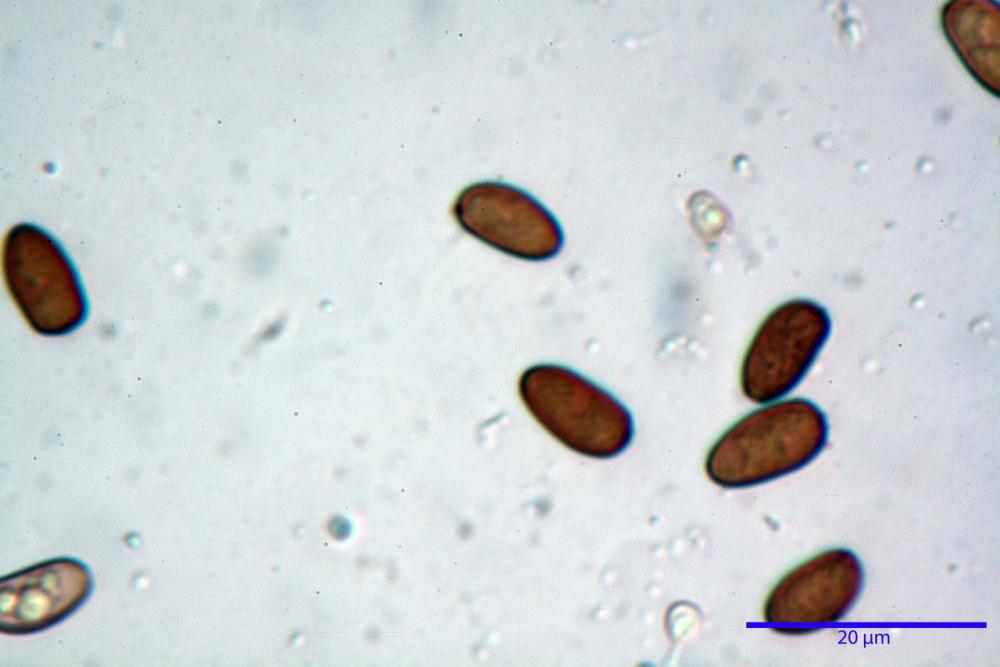
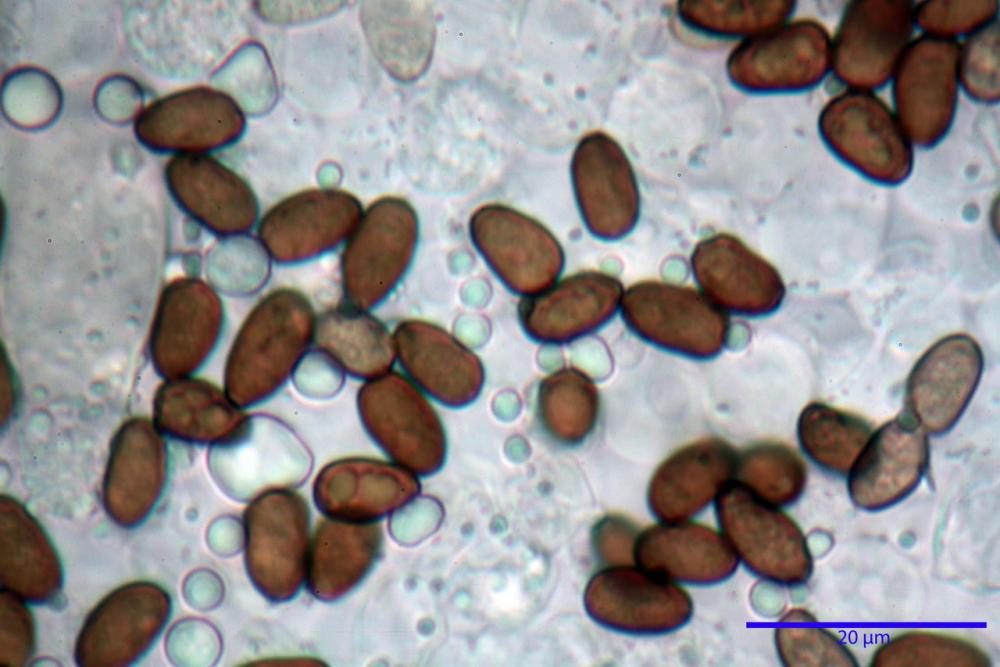
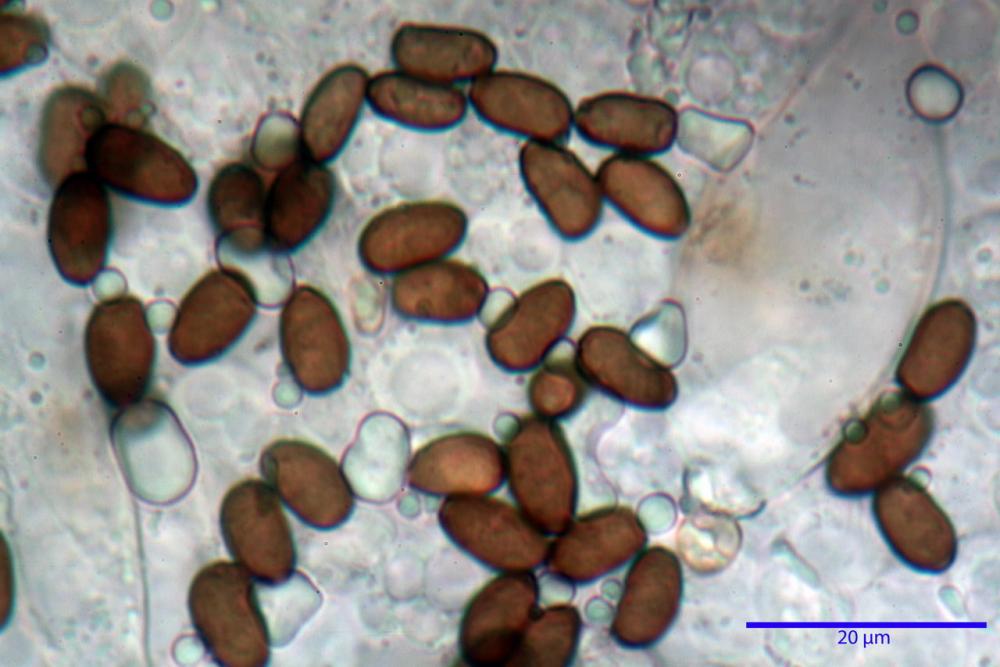
Spore (7,56) 8,72 - 9,45 - 10,24 (10,84) x (4,32) 4,78 - 5,31 - 5,73 (6,20) µm, Q. = (1,54) 1,63 - 1,79 - 1,91 (2,00); Vol. = (81,5) 108,6 - 141,8 - 168,0 (201,4) µm3, faseoliformi in proiezione laterale, da subellittiche a subovoidi in proiezione frontale. Lisce, brunastre in H2O, le spore immature evidenziano un contenuto granulare verdastro ed una grossa guttula centrale; parete spessa fino a 0,5 µm, poro germinativo indistinto 0,7 - 0,85 - 1,0 µm, appendice ilifera poco evidente.
Basidi (18,5) 20,6 - 22,79 - 26,8 (27,3) x (6,5) 7,4 - 8,6 - 9,3 (10,6) µm, Q. = (2,2) 2,2 - 2,66 - 3,3 (3,5); Vol. = (517,8 )546 - 901,4 - 1136,82(1454,4) µm3, clavati, tetrasporici, ialini.
Trama lamellare non investigata.
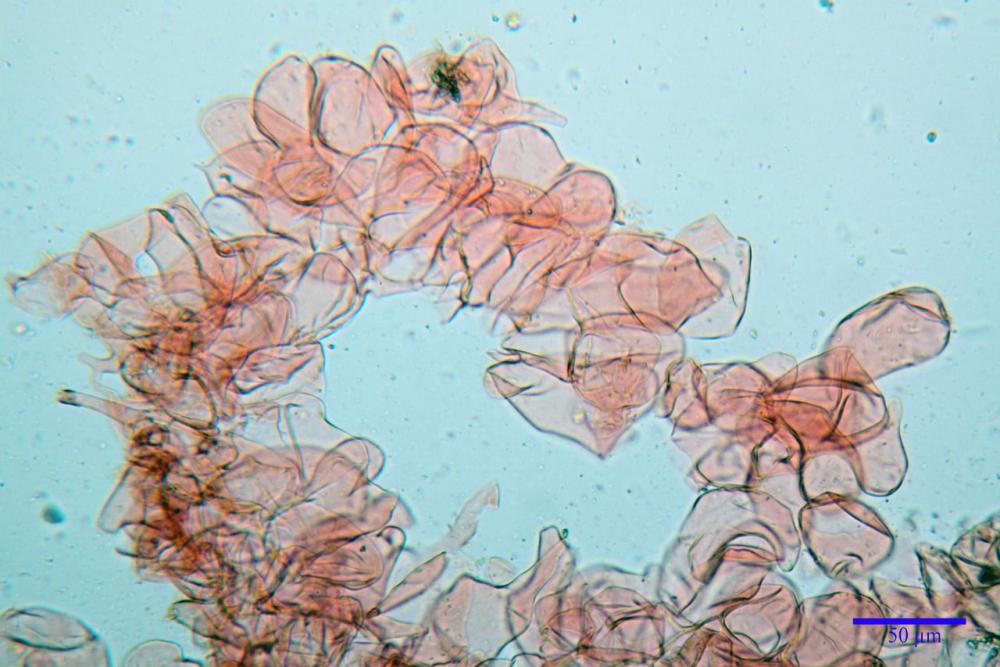
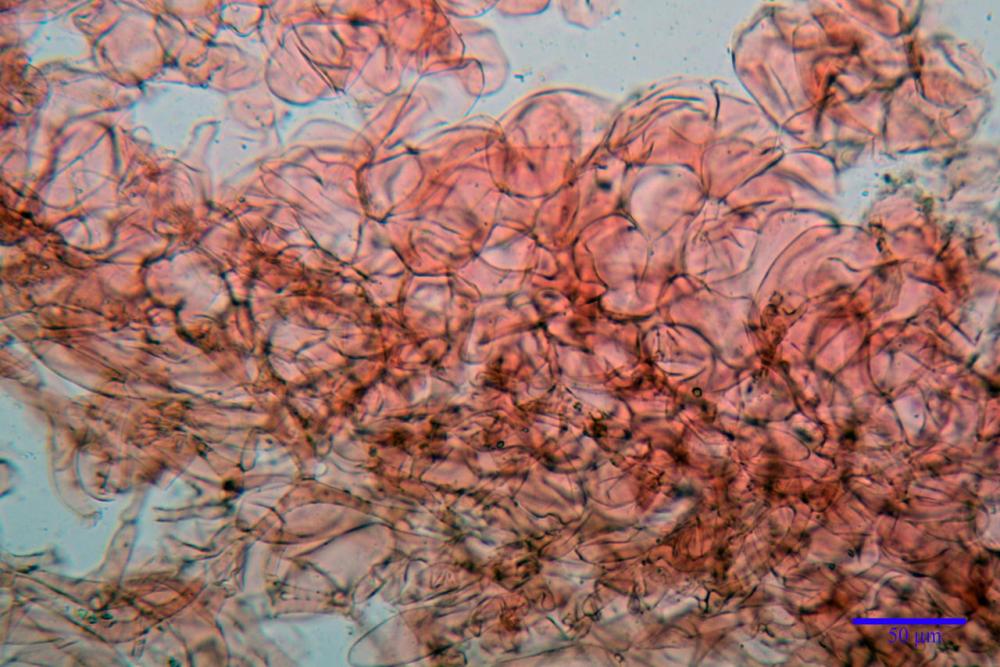
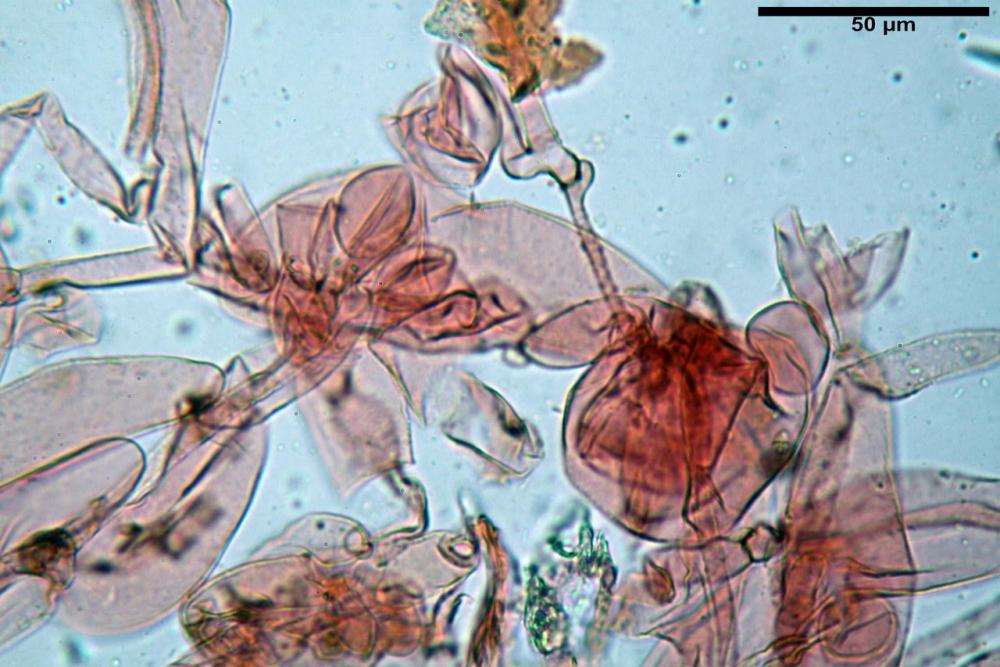
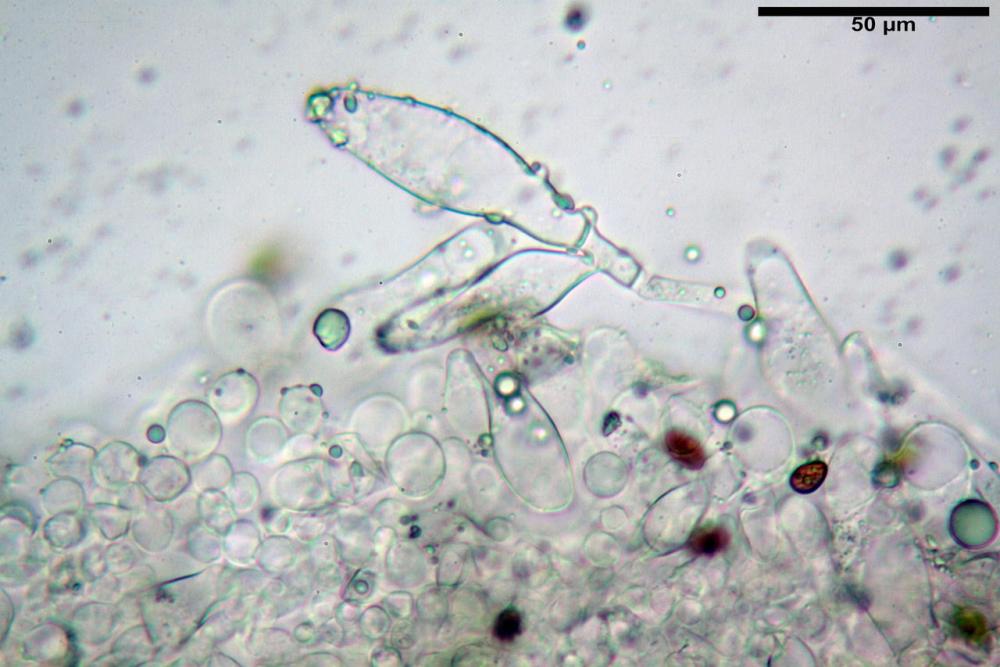
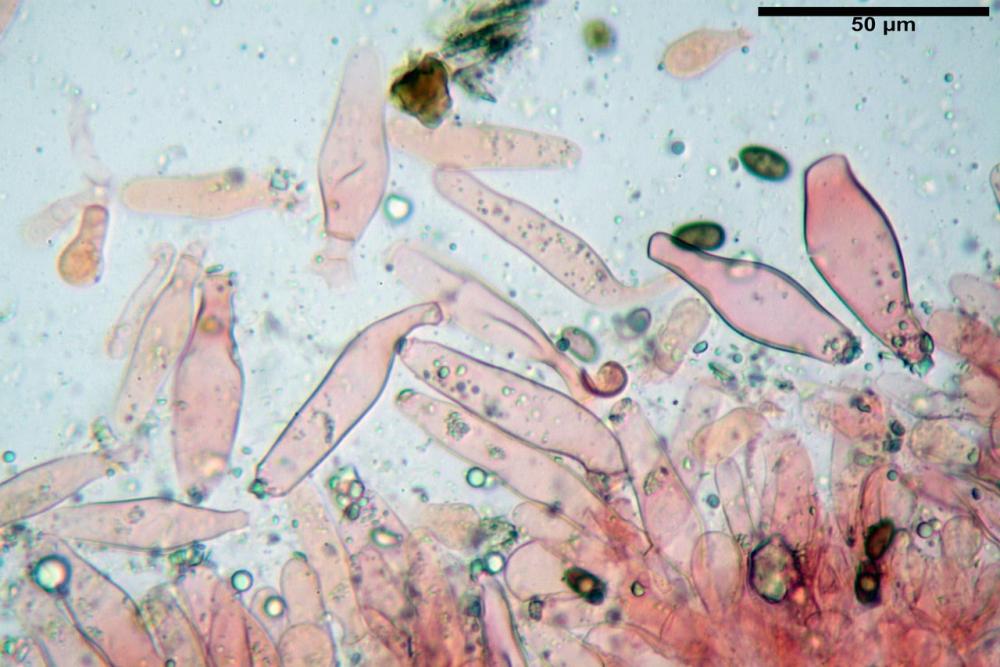
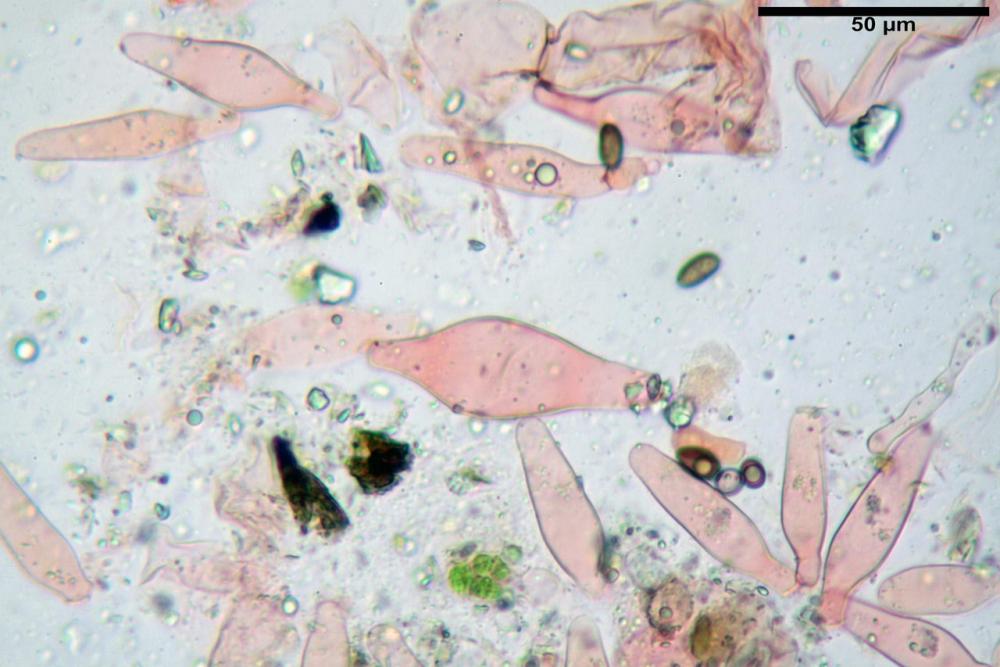
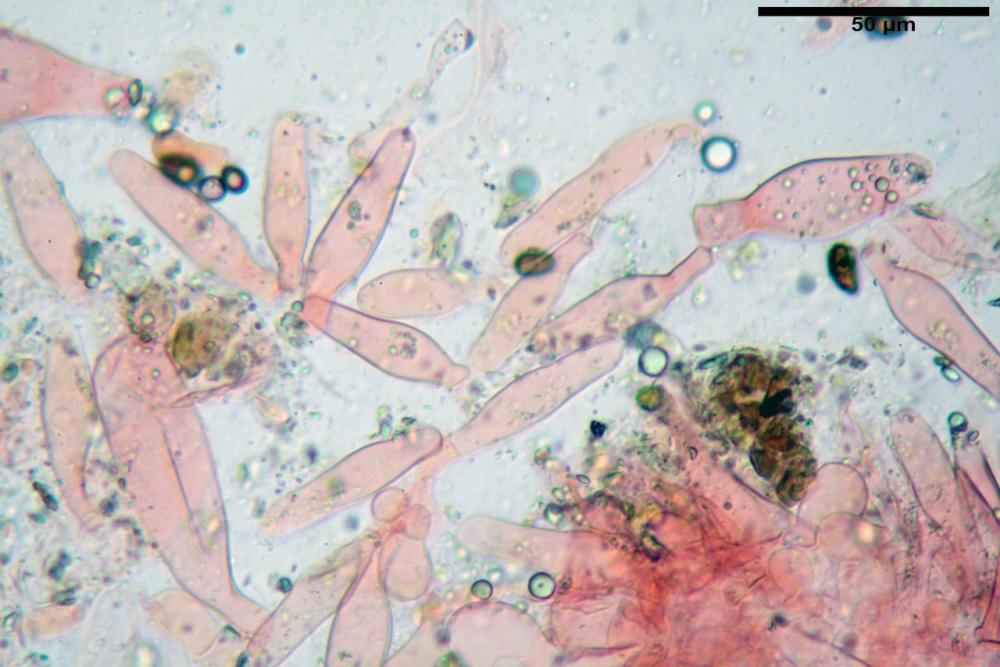
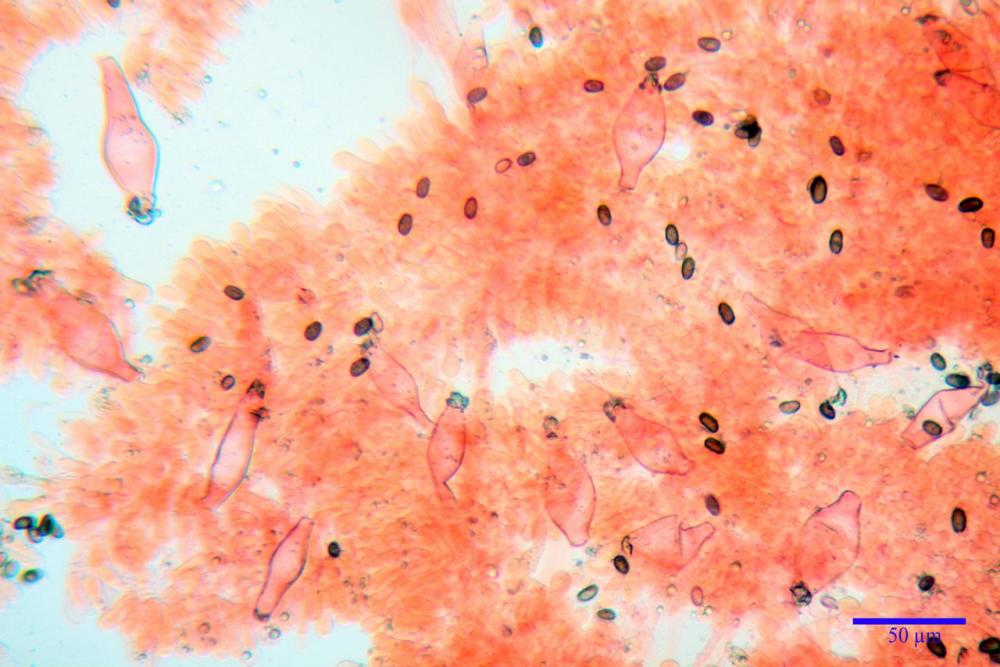
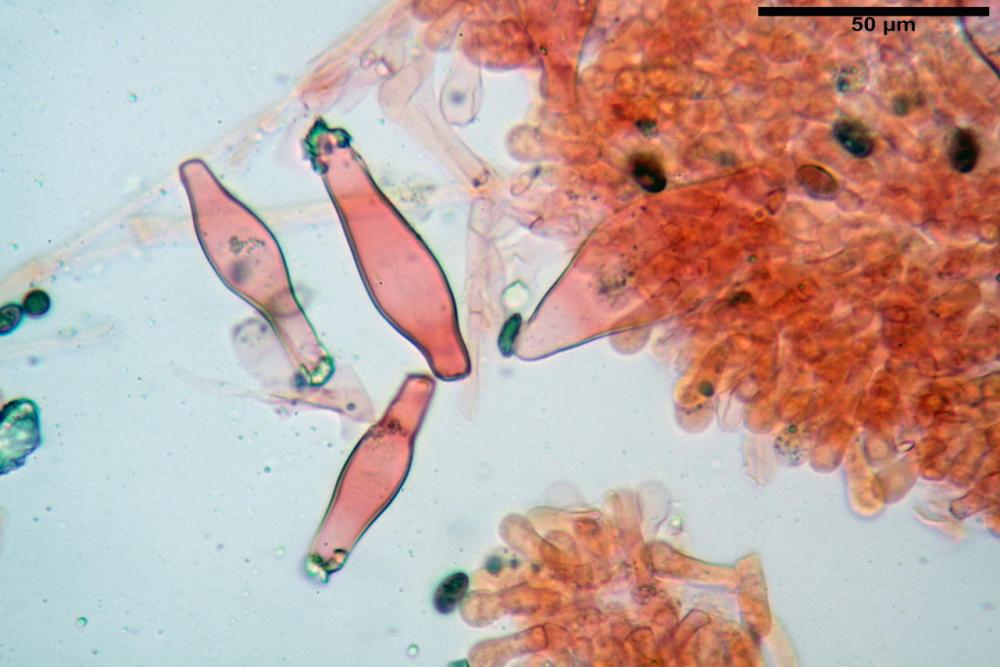
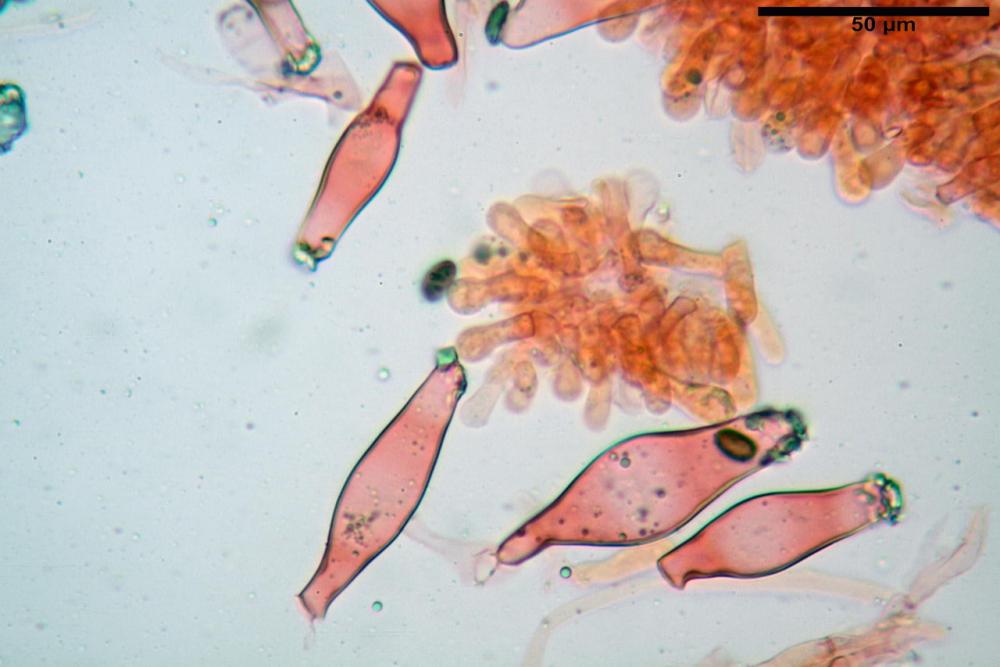
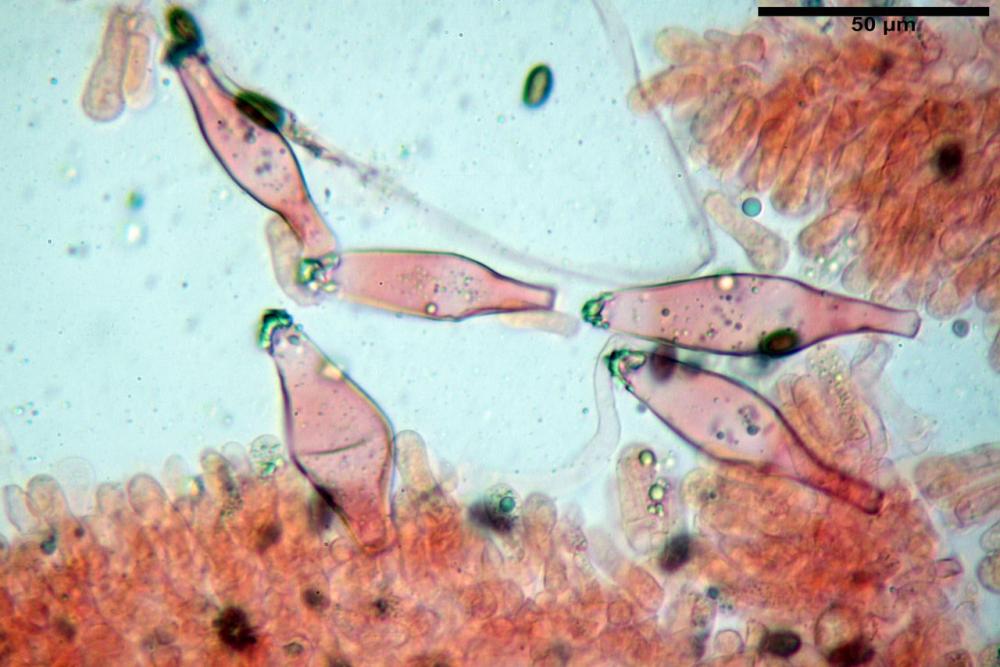
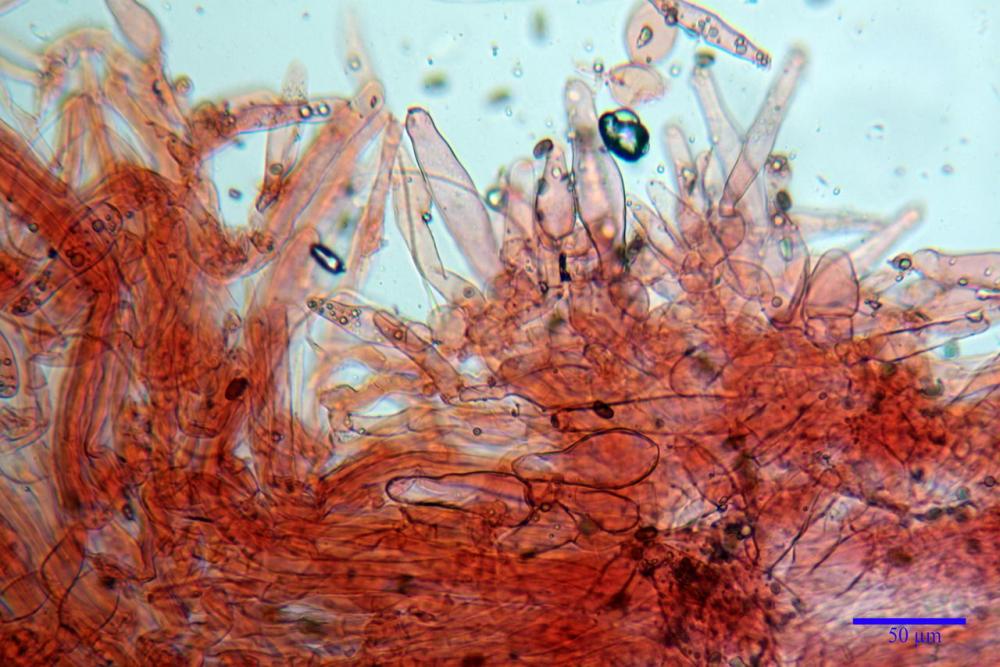
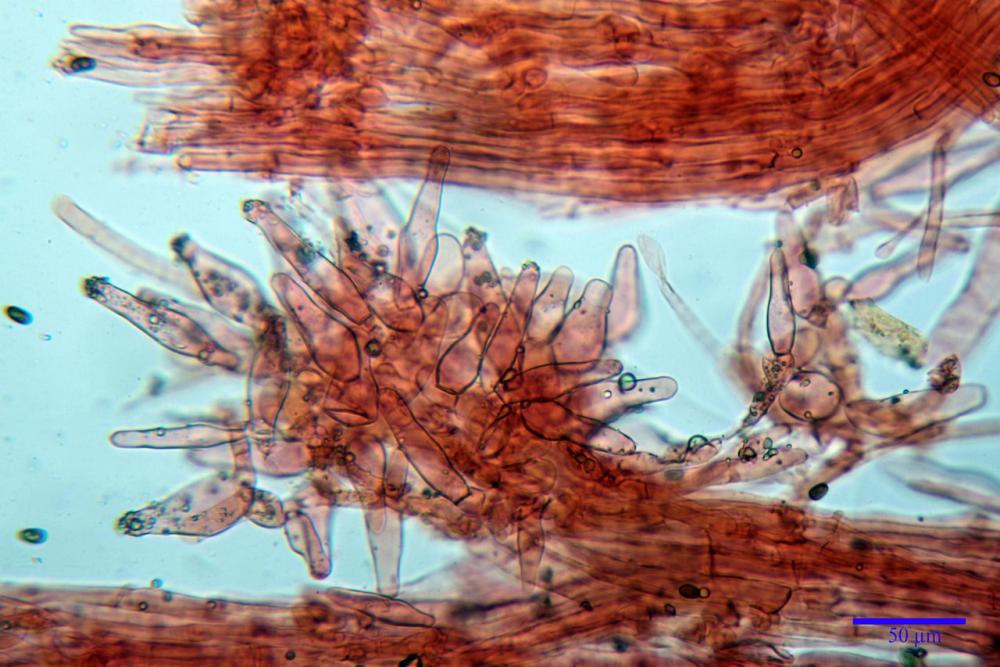
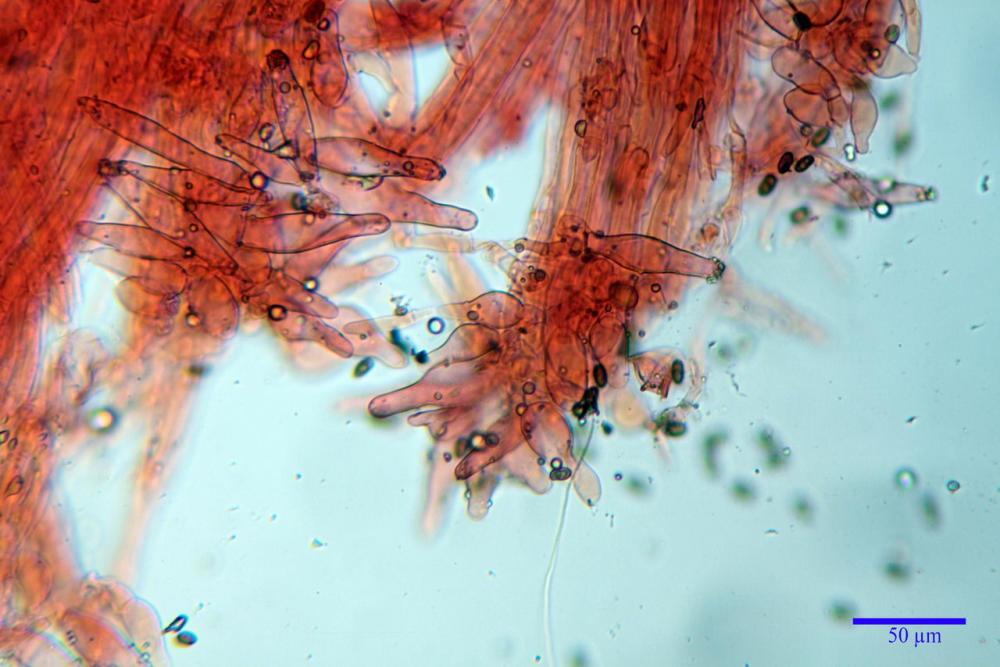
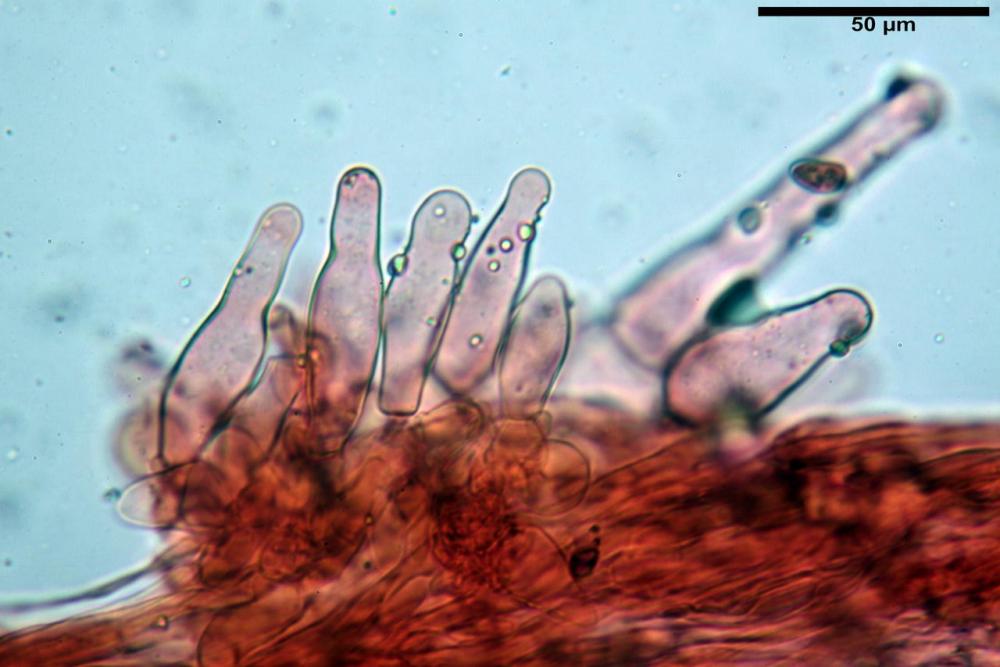
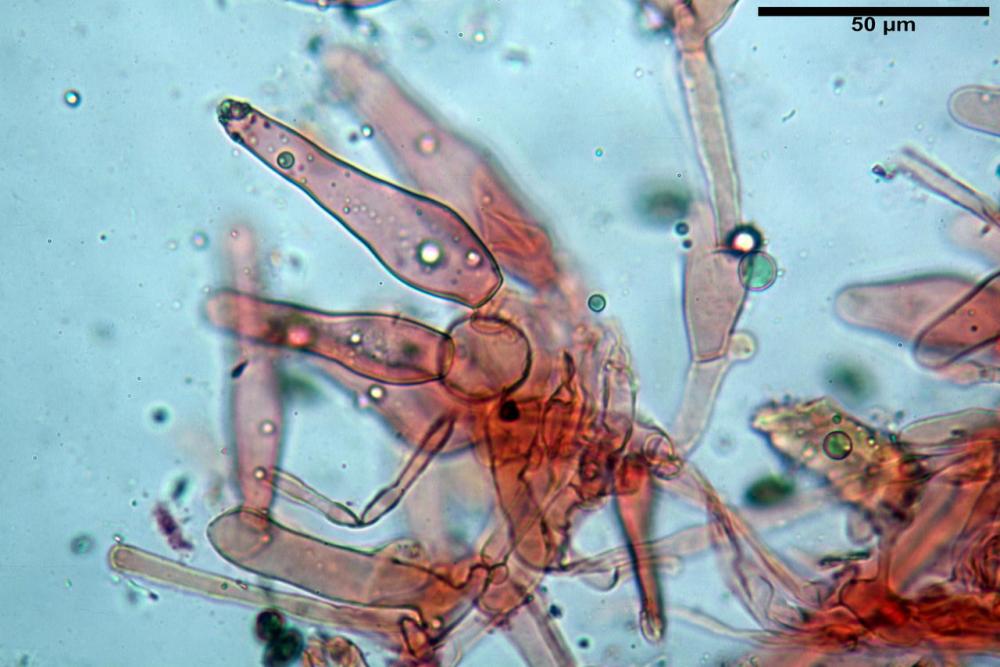
Cheilocistidi metuloidi (39,4) 42,5 - 51,65 - 60,4 (63,6) x (10,2) 11,4 - 13,84 - 17,2 (18,9) µm, Vol.m.= (2858) 3123,38 - 3964 - 9451 (10507) µm3, da strettamente a largamente lageniformi con apice ottuso, in maggior parte con tozzo pedicello basale, in alcuni casi lungo e stretto, in rari casi assente, spessore parietale misurato al centro (0,5) 0,6 - 0,78 - 1,0 (1,1) µm, di spessore uniforme per tutta la lunghezza della parete. Contenenti al loro interno granuli lipidici di colore verdastro. Muricazione molto scarsa, spesso assente. Numerosissimi, frammisti a cellule sferopeduncolate. Filo lamellare sterile.
Paracistidi (7,2) 11,7 - 17,02 - 22,1 (23,8) x (4,8) 5,5 - 9,67 - 12,5 (12,8) µm, Vol.m.= (113) 167 - 1849 (1919) µm3, da sferopeduncolati a clavati, raramente subcilindrici, parete sottile, ialini, non molto numerosi, inframezzati ai metuloidi.
Pleurocistidi metuloidi (45,0) 47,0 - 57,42 - 68,7 (73,5) x (11,3) 12,0 - 17,8 - 25,9 (28,6) µm, Vol.m.= (3159) 4034 - 5738 - 20416 (28974) µm3 da strettamente a largamente lageniformi con apice ottuso, in maggior parte con tozzo pedicello basale, spessore parietale misurato al centro (0,7) 0,8 - 1,17 - 1,5 (1,54) µm. Contenenti al loro interno granuli lipidici di colore verdastro. Muricazione notevole e persistente. Abbastanza numerosi.
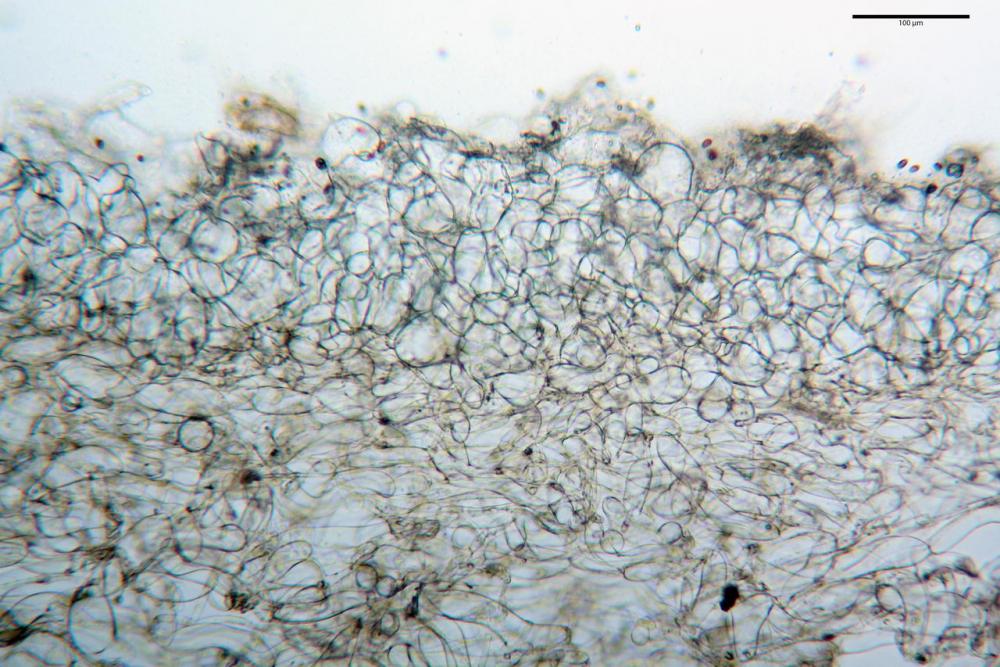
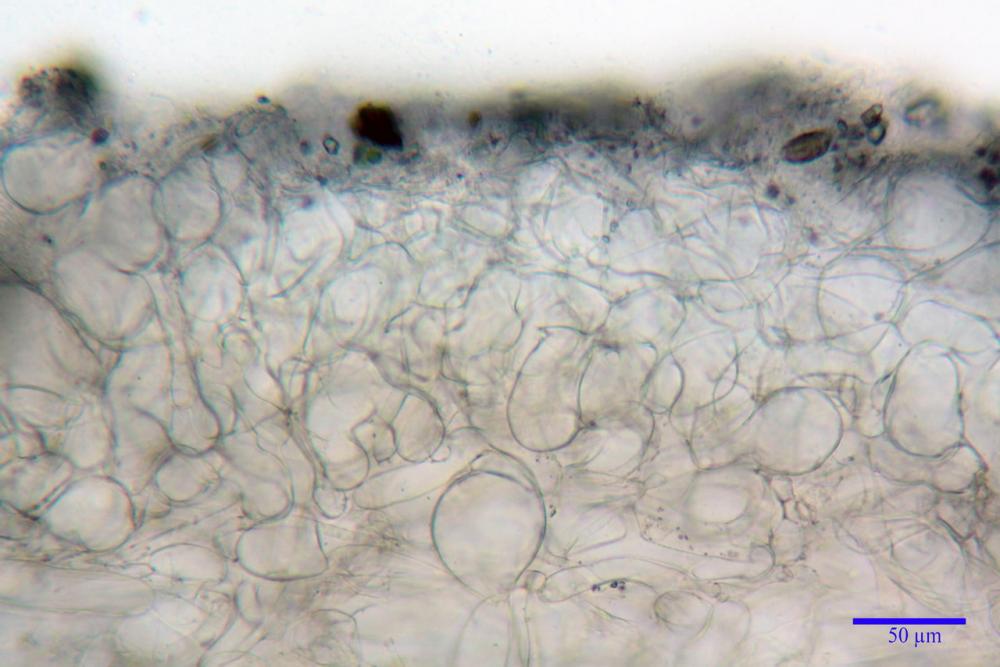
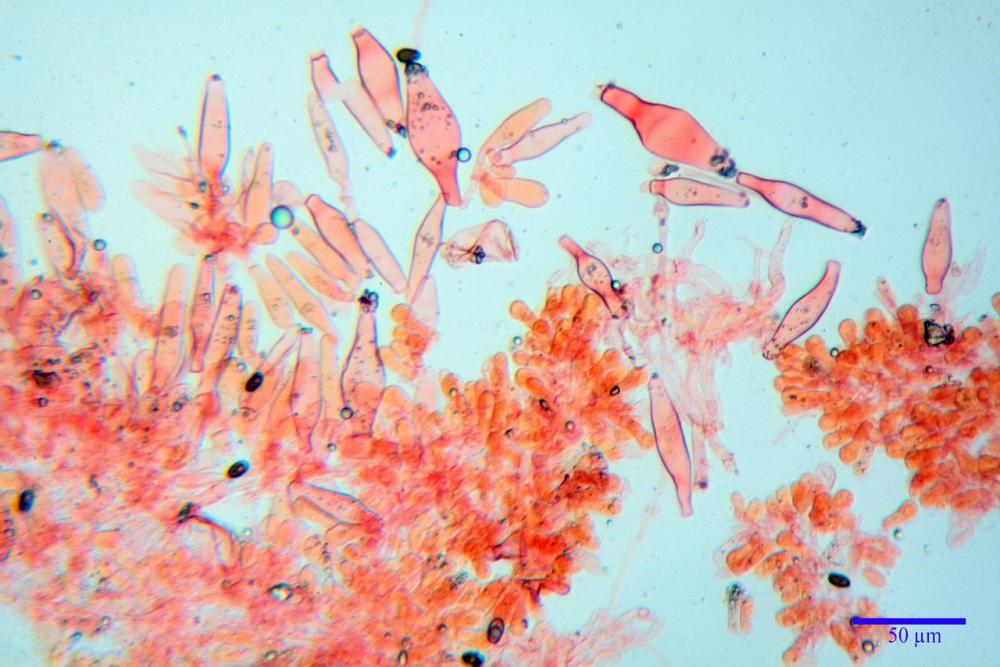
Pileipellis (49,2) 50,4 - 65,91 - 81,6 (86,6) x (26,0) 26,8 - 41,77 - 55,6 (56,6) µm, Q. = 1,26 - 1,84 - 1,8 (2,5); Vol. = (18615) 110621 - 33666 – 94346 (145749) µm3, formata da un’imeniderma con transizione in epitelio, composta da cellule più o meno pedicellate, ialine. Pileocistidi non osservati.
Caulopellis (3,6) 4,4 - 7,10 - 8,7 (11,4) µm, tipo cutis, formata da ife cilindriche, ialine.
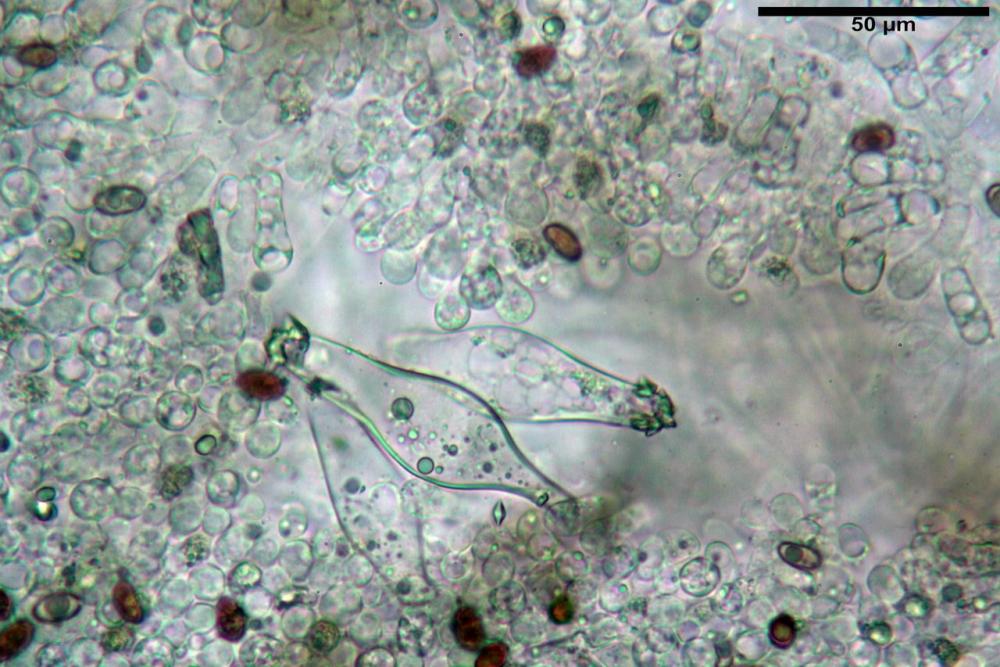
Caulocistidi metuloidi (37,0) 43,8 - 59,27 - 78,7 (89,1) x (10,4) 12,2 - 16,15 - 20,8 (25,0) µm, Vol.= (2467) 3850 - 8479 - 13729 (19895) µm3, simili ai cistidi imeniali, con parete leggermente più sottile e muricazione mediamente persistente, frammisti a cellule clavate (14,1) 14,5 - 25,56 - 34,3 (35,5) x (12,5) 13,1 - 17,11 - 21,9 (27,4) µm, Vol.m.= (1282) 1361 - 4206 - 7286 (10270) µm3, da subclavate a subcilindriche, a parete sottile, ialine, disposti in folti e numerosi gruppetti, distribuiti nei primi 2-3 mm, assenti più in basso.
Giunti a fibbia presenti in tutti i tessuti del basidioma.
Osservazioni
Nel lavoro sulla filogenetica molecolare delle Psathyrellaceae (Örstadius, Ryberg & Larsson, 2015), gli Autori delimitano le Psathyrella sensu stricto sistemando all’interno del pygmaea clade le specie sottoelencate tra le quali viene posta anche il nostro taxon:
Psathyrella arenosa Örstadius & E. Larss., in Örstadius, Ryberg & Larsson, (2015).
P. abieticola A.H. Sm., (1972).
P. conferta Eyssart. & Chiaffi, (2004).
P. fusca (J.E. Lange) A. Pearson, (1952).
P. rybergii Örstadius & E. Larss., in Örstadius, Ryberg & Larsson, (2015).
P. pygmaea (Bull.) Singer, (1951) [1949].
P. panaeoloides (Maire) Arnolds, (1982).
P. reticulata (Romagn.) M.M. Moser ex Singer, (1969).
P. saponacea F.H. Møller (1945).
P. stridvallii Örstadius & E. Larss. (2015).
Sinteticamente, vado ad elencare le caratteristiche anatomiche ed edafiche per la determinazione di questo taxon:
- spore in media lunghe 9-10 µm;
- presenza di pleurocistidi da lageniformi a strettamente utriformi, con apice ottuso;
- cheilocistidi più o meno muricati, non ricoperti da sostanza mucosa verdastra in soluzione ammoniacale;
- basidi tetrasporici;
- presenza di giunti a fibbia;
- presenza di un vistoso velo ifale;
- assenza di anello membranoso sullo stipite;
- superficie pileica non fibrillosa;
- crescita lignicola.
Dati di raccolta e Habitat
N. scheda: 5765. Data di ritrovamento: 15/11/2015, Località: Brezovica pri Gradinu. Comune: Koper, (SLO). Coordinate geografiche: 45°27'2.10"N 13°51'3.18"E. Altezza s.l.m.: 434. Habitat: Su ceppaia marcescente di Robinia pseudoacacia, ai bordi del sentiero. Legit: de Benigni S., Dagnolo V., Zugna M. Determinatore: Zugna M.
Data inserimento in erbario: 22/11/2015
Materiali e Metodi
Lo studio è stato compiuto su materiale fresco. I preparati sono stati osservati usando come mezzo di governo H2O; ove necessario, si è adoperato Rosso Congo Ammoniacale 2 % per meglio evidenziare le differenti tipologie cellulari. Le misure microscopiche sono state eseguite con il software di calcolo Mycométre gentilmente fornitoci dal Sig. Georges Fannechère e prelevabile a questo indirizzo http://mycolim.free.fr. Le misure sporali si riferiscono a 100 unità, effettuate in proiezione lateralesenza tener conto dell’apiculo o, nel caso di spore inequilaterali, anche in proiezione frontale, ottenute da sporata o prelevate da altre zone non imeniali, scartando spore ancora evidentemente immature, per le rimanenti tipologie cellulari si sono eseguite un minimo di venti misure a tipologia. Le misure sottolineate si riferiscono alle medie. Per la terminologia riguardante la tipologia delle caratteristiche macro e microscopiche, si fa riferimento a (Vellinga EC. 1988). Per quanto riguarda la nomenclatura aggiornata ed i nomi degli Autori, abbiamo fatto riferimento a http://www.indexfungorum.org e http://www.mycobank.org.
Le foto in habitat sono state eseguite con l’ausilio di una fotocamera Reflex EOS 5D Mark II, obiettivo Canon EF 100mm f/2.8 Macro USM. Per le osservazioni dei caratteri macroscopici, in alcuni casi, ci siamo valsi di uno stereo microscopio Optech trinoculare e del supporto di foto macro ad alta risoluzione. Le foto concernenti la microscopia, sono state eseguite con l’ausilio di una fotocamera Reflex EOS 50D, posto sul terzo occhio di un microscopio biologico Optech Biostar B5, supportato da ottiche Plan-APO, illuminazione alogena 12V-50 W a luce riflessa, con regolatore d'intensità. Le collezioni d’erbario sono conservate nell'erbario A.M.B. Gruppo di Muggia e del Carso.
Bibliografia consultata
Fouchier F., 1995 – Le Genre Psathyrella – Flore des espécies europeénne et méditerranéennes.
Hausknecht A., I. Krisai-Greilhuber (1997): Some rare Agaricales with brown or darkerspores. Fungi Non Delineati Pars II. Edizioni Candusso 1997.
Kits van Waveren, E. (1985). The Dutch, French and British species of Psathyrella. Persoonia Supplement 2.
Örstadius L. (2001): Psathyrella spadicea - taxonomy and nomenclature. Windahlia 24: 19–24.
Örstadius L. & Knudsen H. in Knudsen H. & Vesterholt J. (2008): Funga Nordica: 586-623 Ed. Knudsen & Vesterholt.
Örstadius L., Ryberg M. & Larsson E. (2015): Molecular phylogenetics and taxonomy in Psathyrellaceae (Agaricales) with focus on psathyrelloid species: introduction of three new genera and 18 new species. Mycol Progress (2015) 14: 25.
Vašutova M. (2008): Taxonomic studies on Psathyrella sect. Spadiceae. – Czech. Mycol. 60 (2): 137–171.
Vašutova M., Antonin V. and Urban A. (2008): Phylogenetic studies in Psathyrella focusing on sections Pennatae and Spadiceae– new evidence for the paraphyly of the genus. – Mycol. Res. 112 (10): 1153–1164.
Bibliografia citata
Vellinga EC. 1988. Glossary. In C Bas, Th W Kuyper, ME Noordeloos, EC Vellinga (eds.). Flora Agaricina Neerlandica 1: 54-64. A.A. Balkema. Rotterdam.
Dal Web
http://www.indexfung...Names/Names.asp
http://www.mycobank.org/MycoTaxo.aspx



 Questa discussione è bloccata
Questa discussione è bloccata