Psilocybe montana var. montana (Pers.) P. Kumm., Führ. Pilzk. (Zwickau): 71 (1871)
Basionimo: Agaricus montanus Pers., Observ. mycol. (Lipsiae) 1: 9 (1796)
Sinonimi: Agaricus montanus Pers., Observ. mycol. (Lipsiae) 1: 9 (1796).
Agaricus montanus Pers., Observ. mycol. (Lipsiae) 1: 9 (1796) var. montanus.
Agaricus physaloides Bull., Herb. Fr. 8: tab. 366 (1788).
Deconica atrorufa sensu auct.; fide Checklist of Basidiomycota of Great Britain and Ireland (2005).
Deconica montana (Pers.) P.D. Orton, Trans. Br. mycol. Soc. 43(2): 175 (1960).
Deconica physaloides (Bull.) P. Karst., Rysslands, Finlands och den Skandinaviska Halföns. Hattsvampar 1: 516 (1879).
Psilocybe atrorufa sensu auct.; fide Checklist of Basidiomycota of Great Britain and Ireland (2005).
Psilocybe physaloides (Bull.) Quél., Mém. Soc. Émul. Montbéliard, Sér. 2 5: 238 [256] (1872).
Descrizione macroscopica
Pileo fino a 10 mm, da campanulato a subemisferico, privo umbone centrale, igrofano, non striato o soltanto per trasparenza, bruno-rossastro.
Lamelle largamente adnate, rade, intercalate da 1/3 lamellule; all'inizio ocracee, poi brunastre; filo lamellare più chiaro.
Stipite 20-30 x 1-2 mm, cilindrico, diritto o sinuosetto, di colore ocraceo, finemente fibrilloso in alto, liscio più in basso, base leggermente allargata.
Carne acquosetta, odore e sapore non rilevati.
Descrizione microscopica
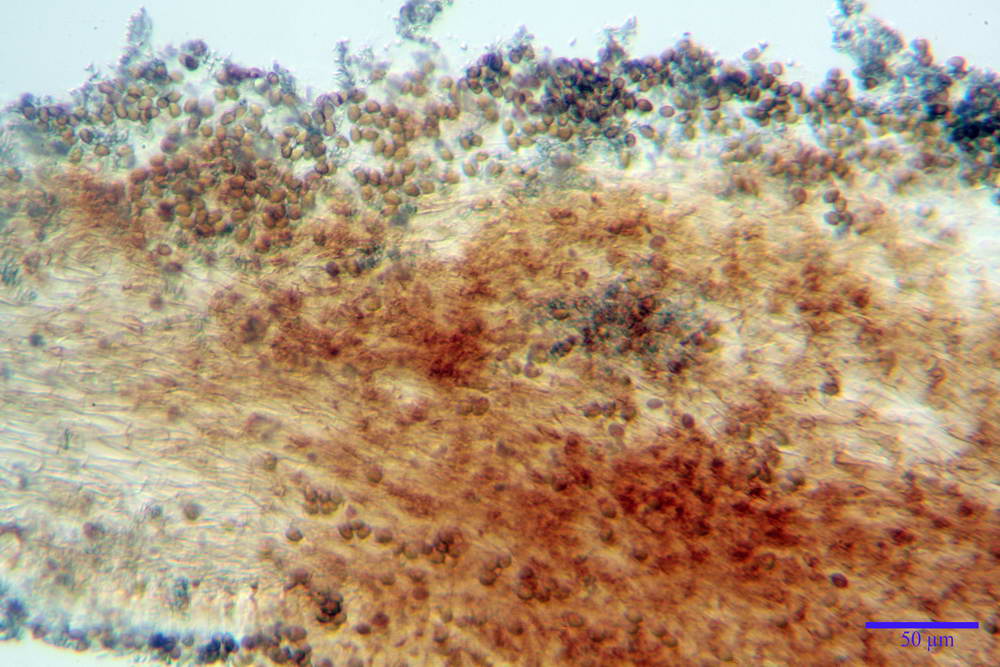
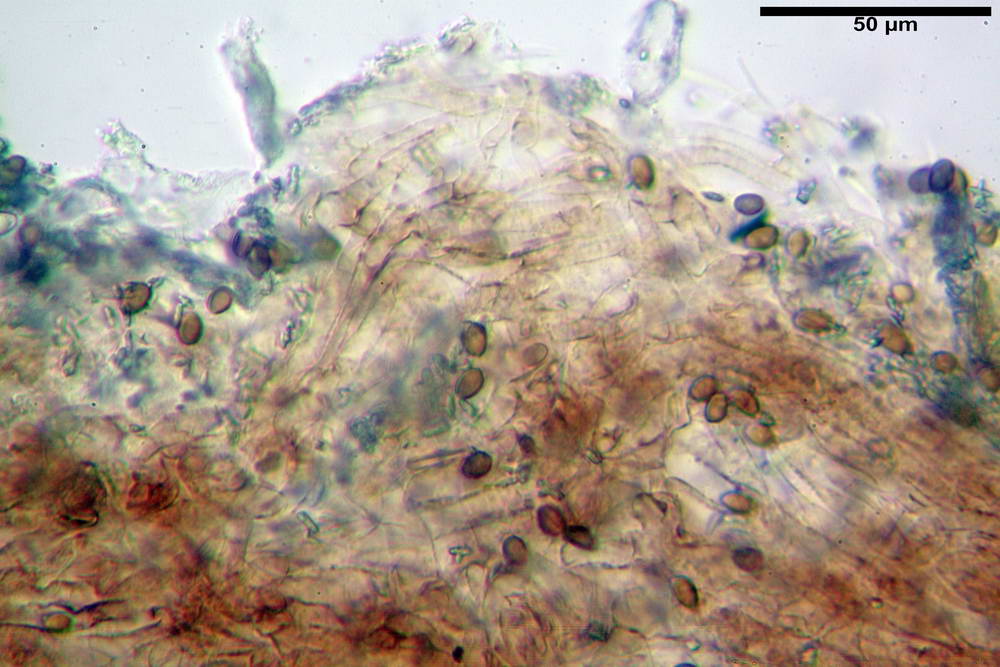
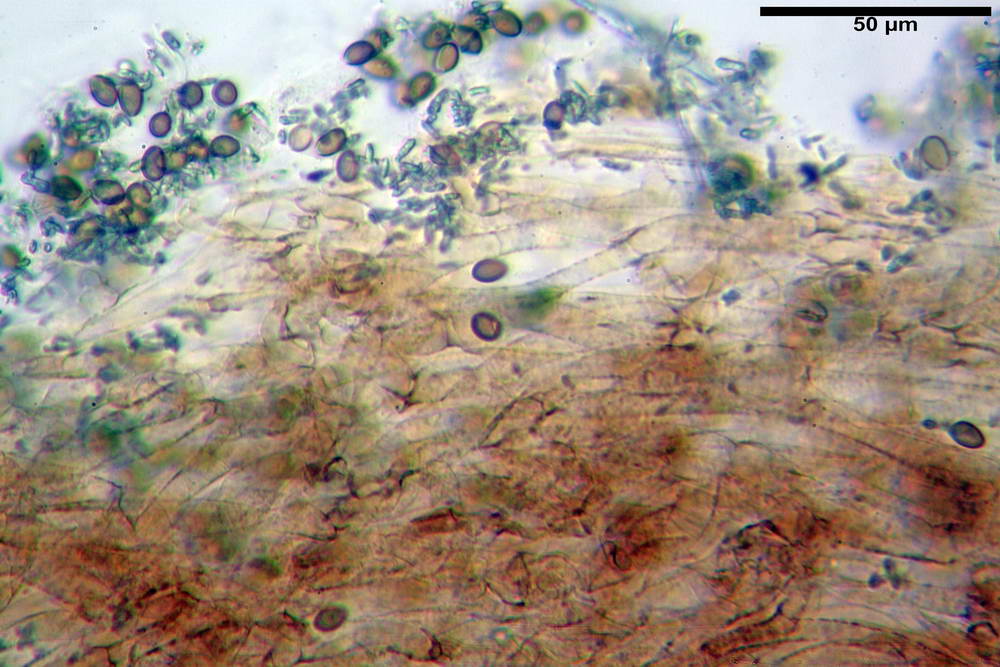
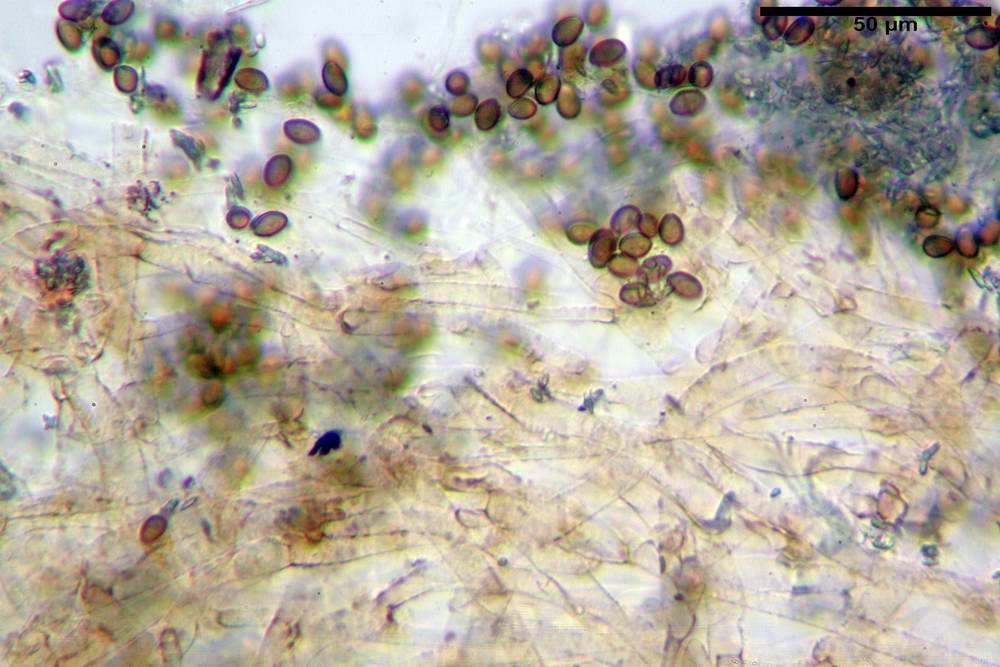
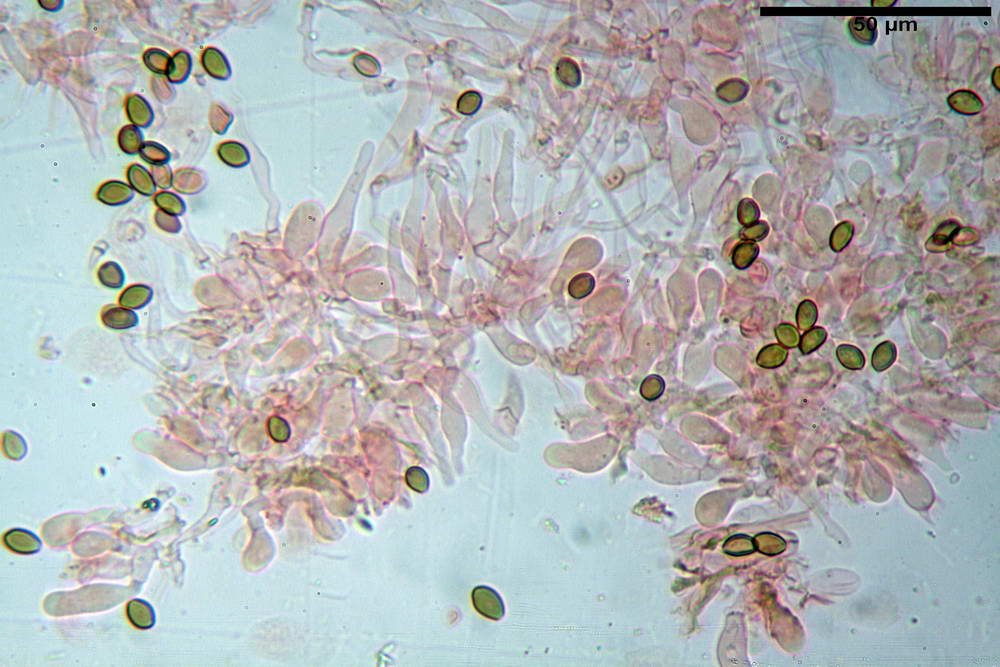
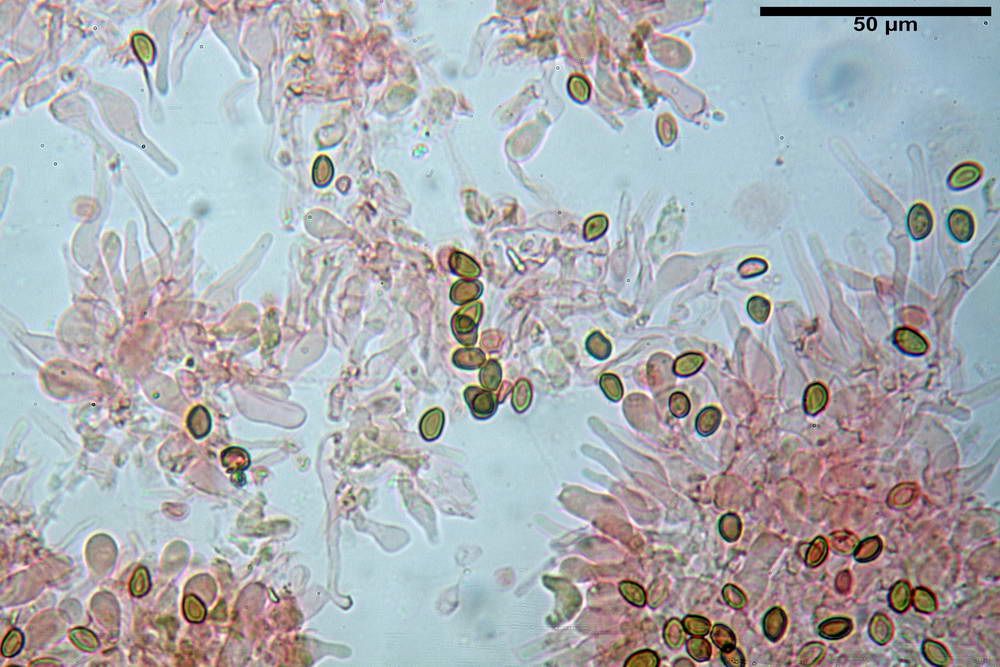
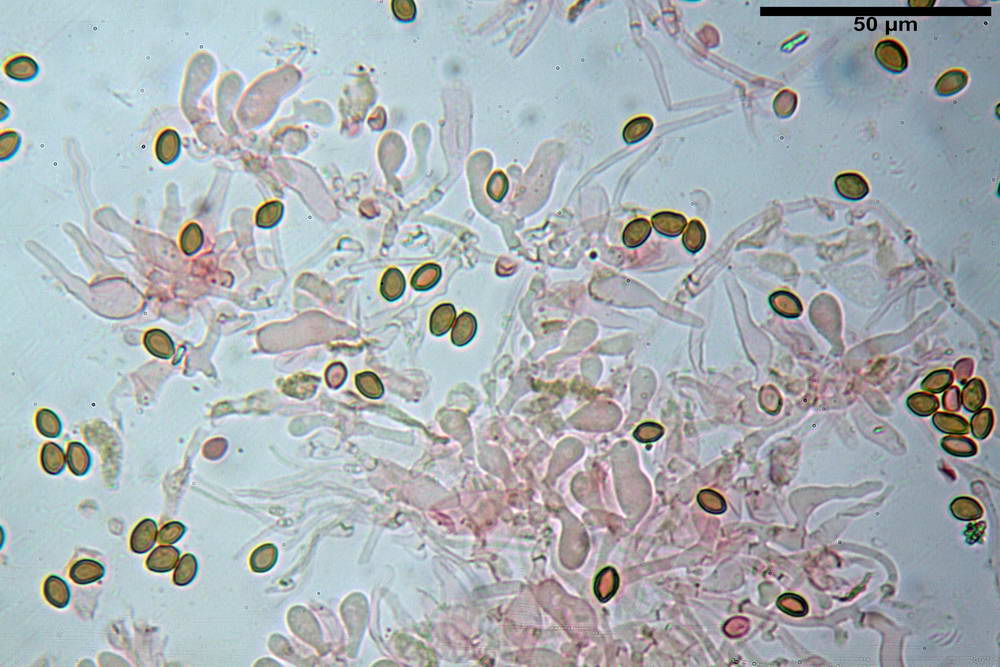
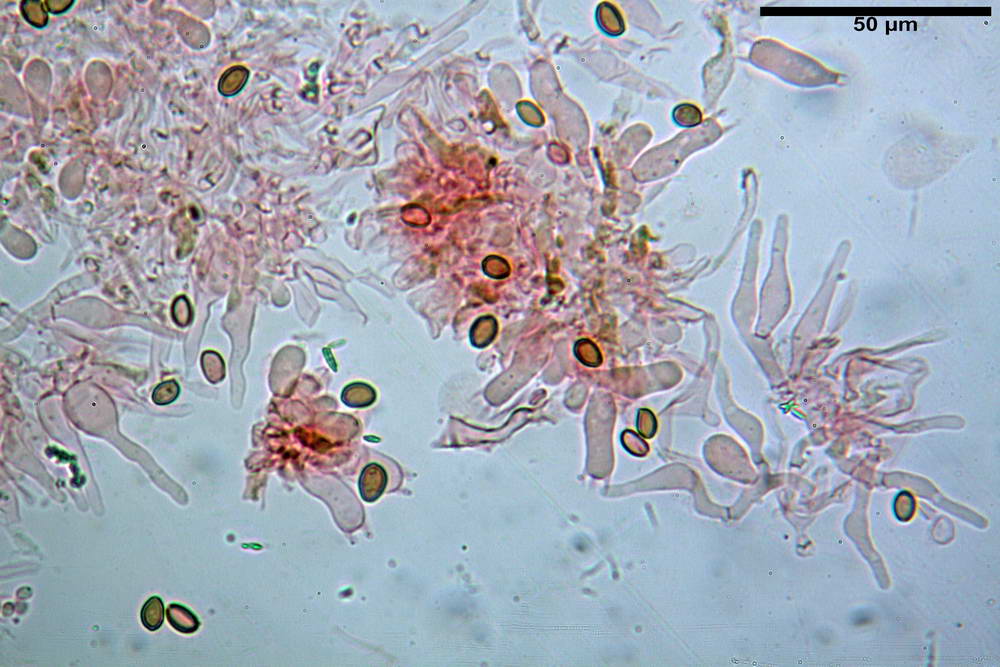
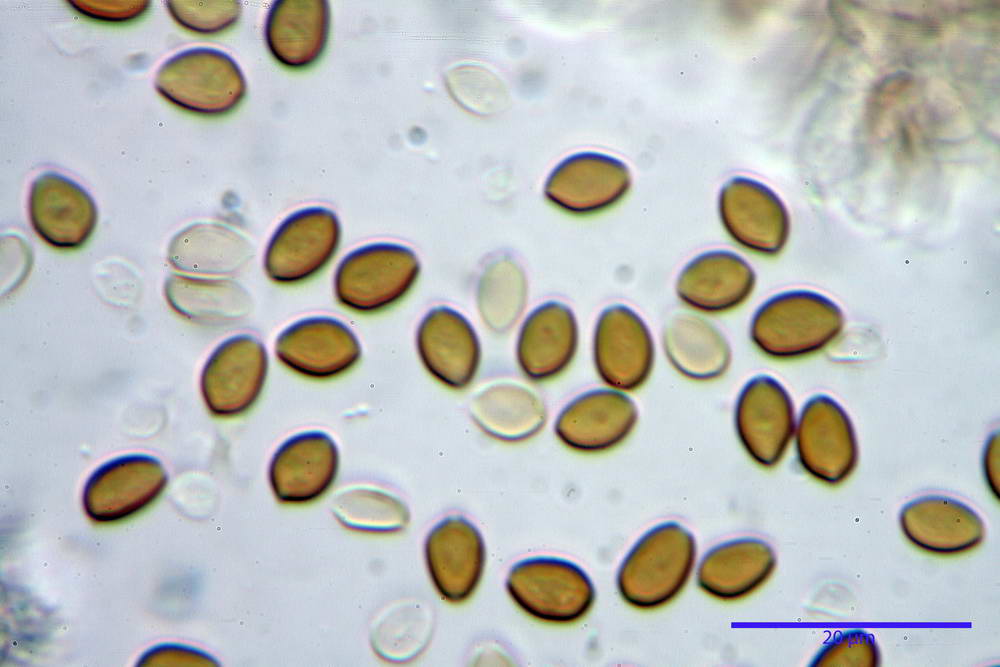
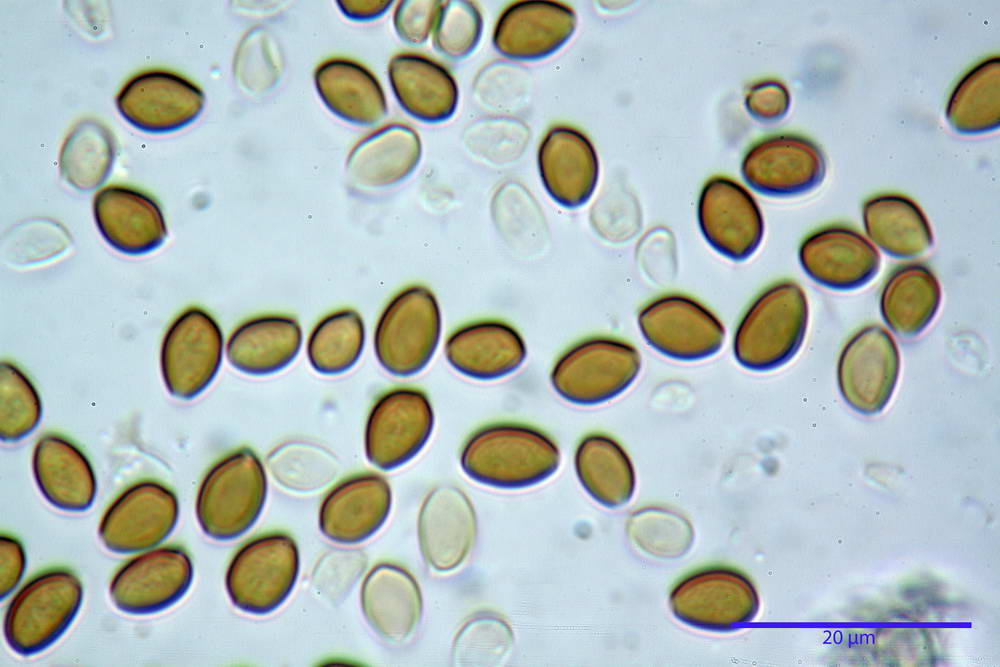
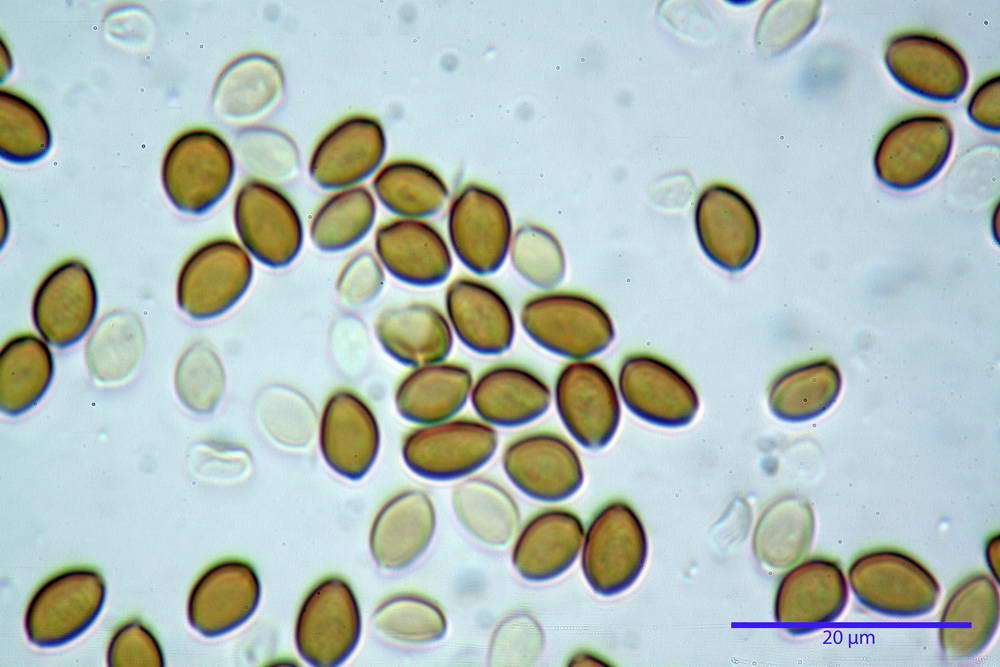
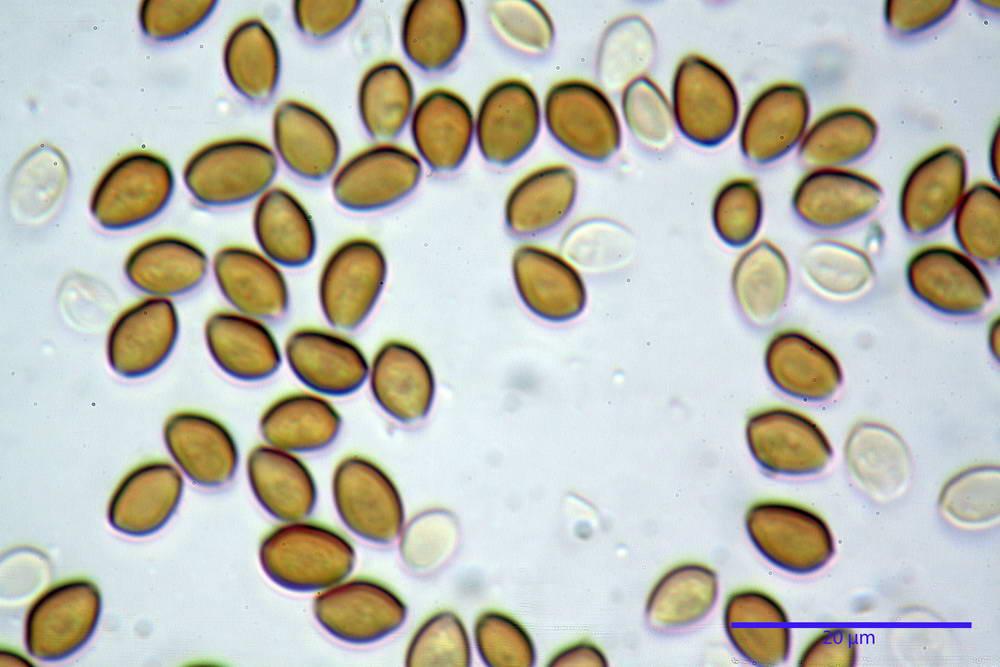
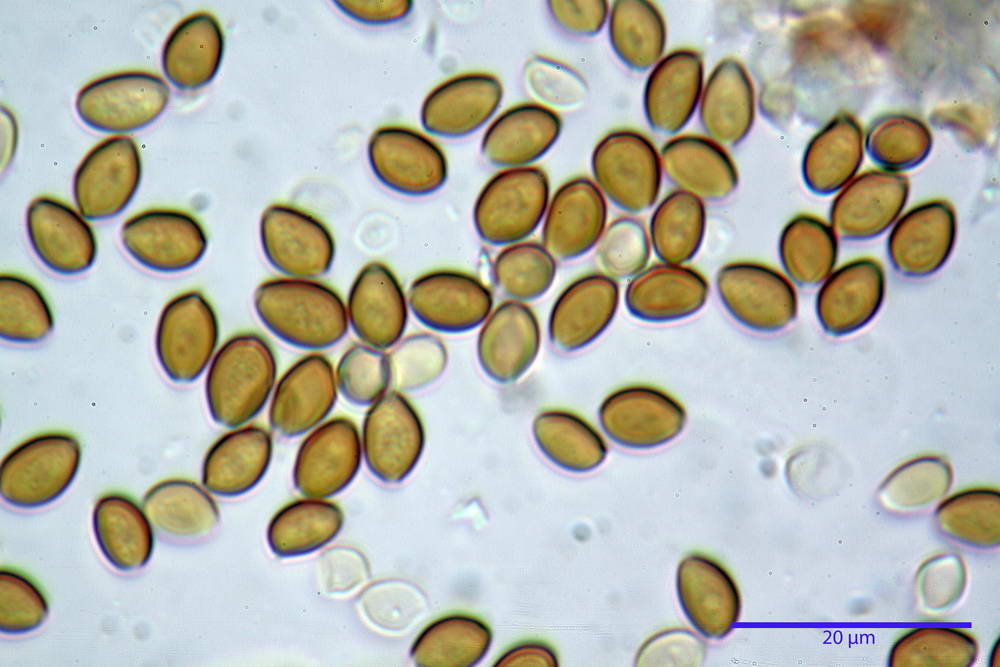
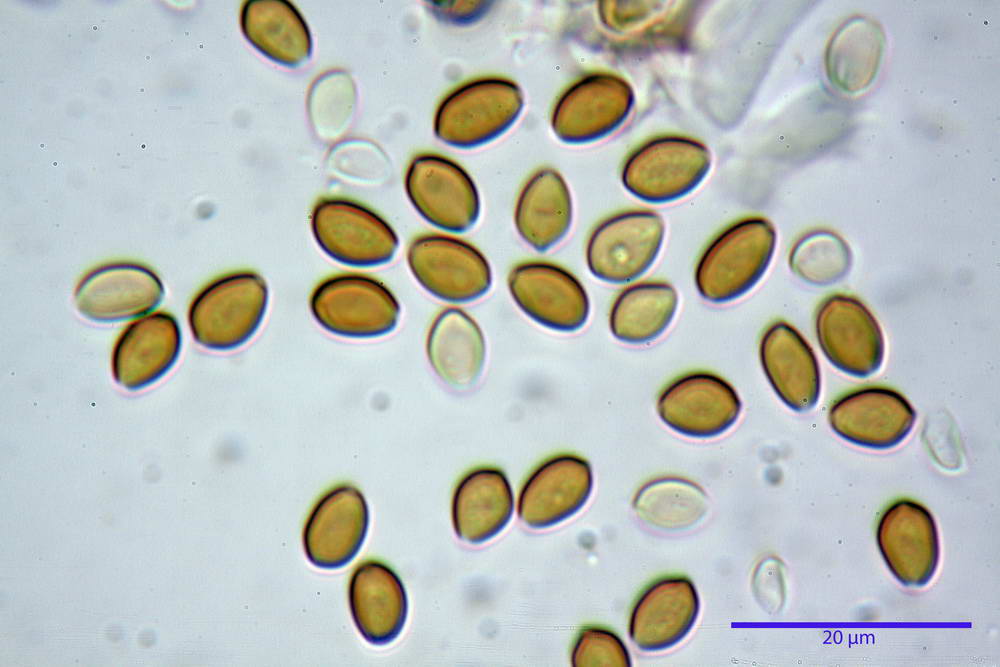
Spore (6,4) 6,6- 7,11 -7,9 (8,2) x (4,1) 4,3- 4,49 -4,9 (5,1) x (4,6) 4,9- 5,10 -5,6 (5,9) µm, Q. = (1,3) 1,4- 1,55 -1,7 (1,7); Vol. = (56) 68- 70 -101 (116) µm³; ovoidi in proiezione frontale, ellissoidi in proiezione laterale, grigio-brunastre in KOH, con parete spessa 0,5- 0,68 -0,8 µm, e poro germinativo largo 0,5- 0,92 -1,4 µm.
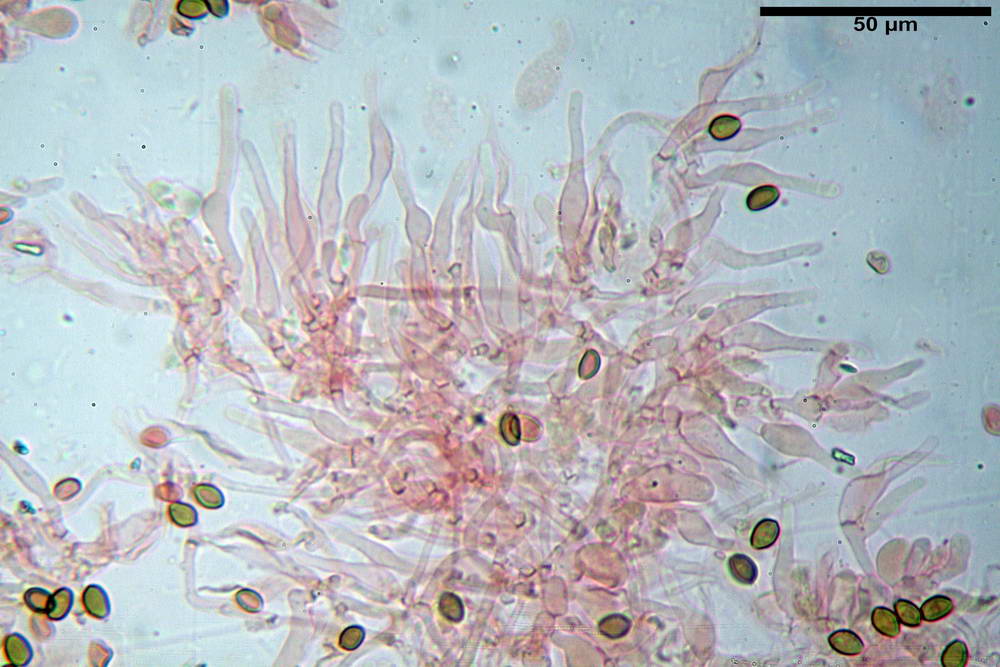
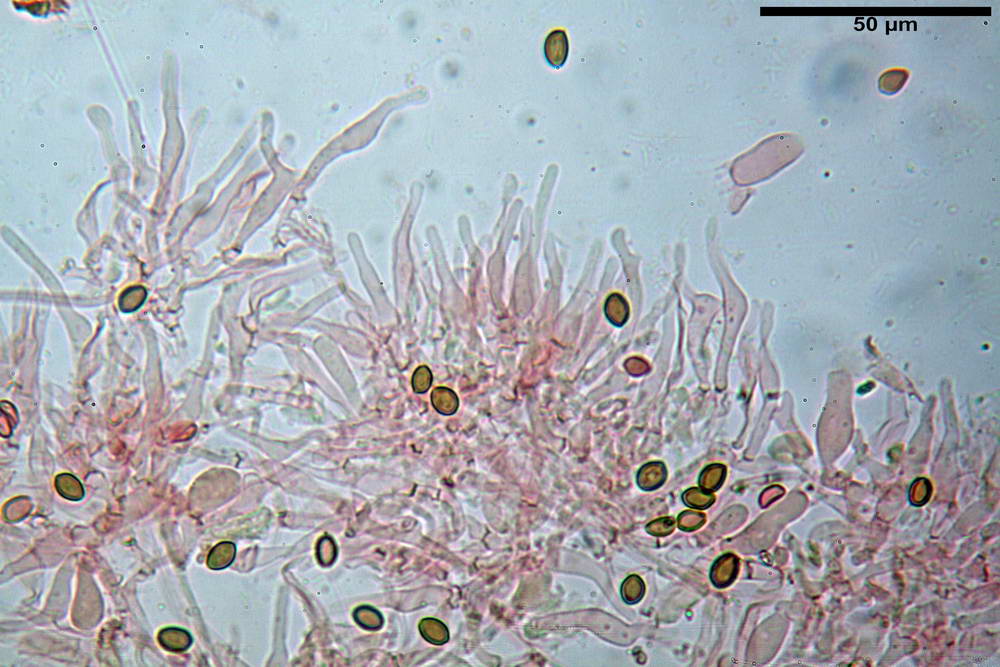
Basidi 18,5- 21,19 -23,6 x 5,9- 7,29 -8,0 µm; Q. = 2,4- 2,95 - 3,4; Vol. = 390- 588 -749 µm³; subclavati, tozzi, spesso con restringimento mediano, tetrasporici; filo lamellare sterile.
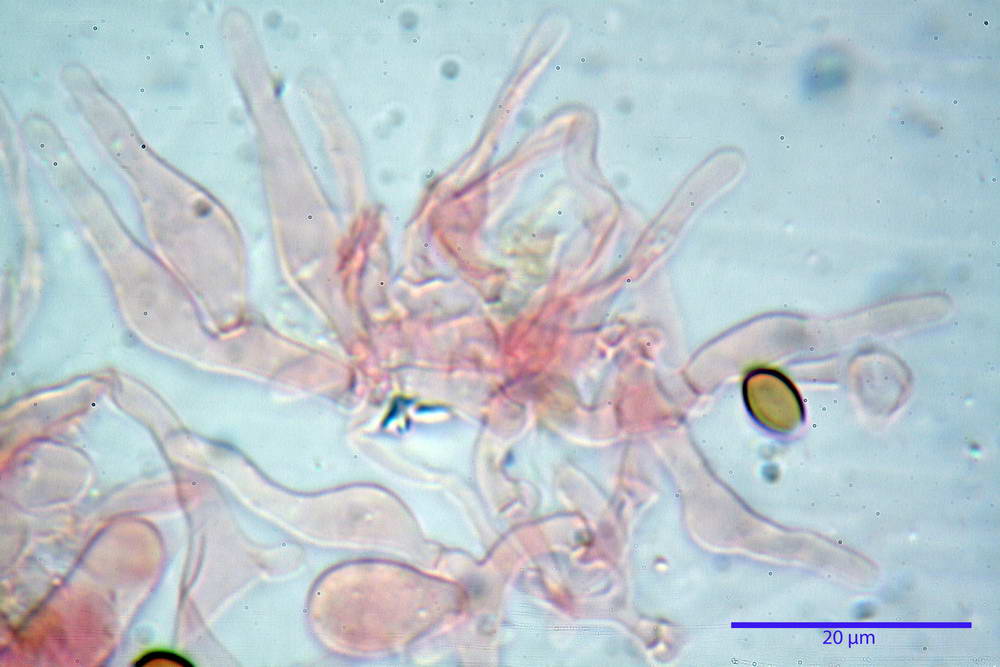
Cheilocistidi 20,3- 22,46 - 42,7 x 4,0- 4,91 -9,5 x 1,3- 2,15 -3,4 µm, strettamente lageniformi con collo lungo ed apice leggermente ristretto; pareti sottili. Pleurocistidi non osservati.
Trama lamellare regolare.
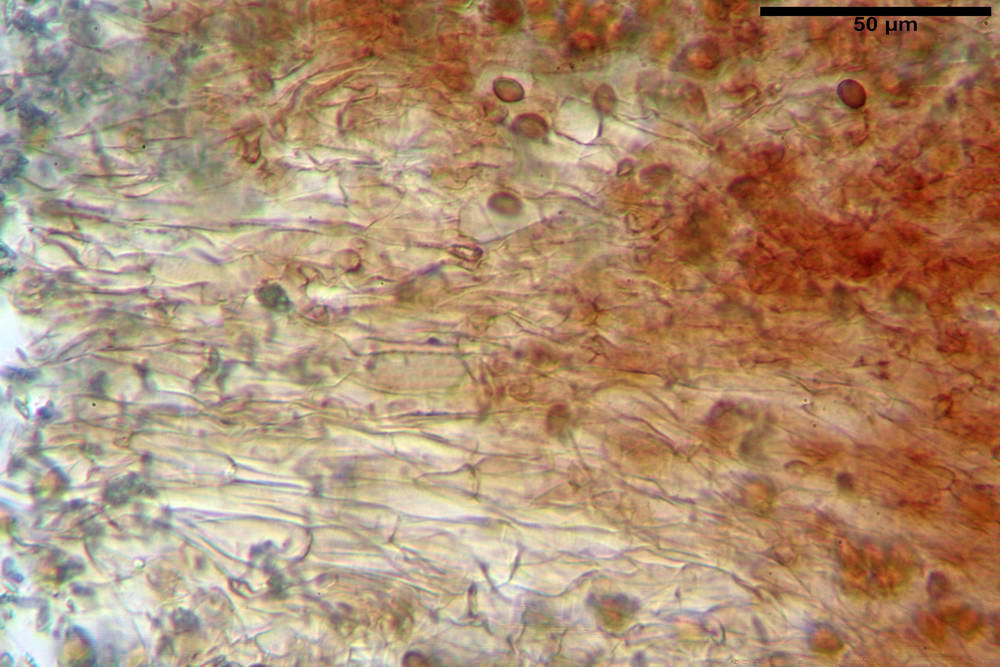
Pileipellis in ixocutis, formata da una sottile strato di ife cilindriche con Ø 2,5-5,6 µm, incrostate, ialine o leggermente pigmentate di bruniccio. Subpellis 17,4-40,3 x 5,0-9,6 µm, formata da ife inflate, incrostate e pigmentate di bruno.
Caulopellis non indagata.
Giunti a fibbia presenti in tutti i tessuti da noi osservati.
Materiali e metodi di studio
La descrizione macroscopica è stata eseguita da foto digitale. Lo studio microscopico sia su materiale secco, reidratati e osservati in H2O, KOH 2%, NH4OH 6%, Rosso Congo anionico. Le misure microscopiche sono state eseguite con il software di calcolo Mycométre gentilmente fornitoci dal Sig. Georges Fannechère e prelevabile a questo indirizzo http://mycolim.free.fr. Le misure sporali si riferiscono a 100 unità, effettuate in proiezione laterale e senza tener conto dell’apiculo, prelevate da zone non imeniali, scartando spore ancora evidentemente immature. Le misure sottolineate si riferiscono alle medie. Per le rimanenti tipologie cellulari si sono eseguite un minimo di venti misure a tipologia. Per la terminologia riguardante la tipologia delle caratteristiche macro e microscopiche, si fa riferimento a Else C. Vellinga1998: Flora Agaricina Neerlandica 1- Chapter 8; Glossary. Per quanto riguarda la nomenclatura aggiornata ed i nomi degli Autori, abbiamo fatto riferimento a http://www.indexfung...names/Names.asp e http://www.mycobank.org/MycoTaxo.aspx. Per le osservazioni dei caratteri macroscopici, in alcuni casi, ci siamo valsi di uno stereo microscopio Optech trinoculare e del supporto di foto macro ad alta risoluzione. Le foto macro sono state effettuate in laboratorio, con l’ausilio di una fotocamera Reflex Canon EOS 50D + obiettivo Canon EF 100mm f/2.8 Macro USM. Le foto concernenti la microscopia, sono state eseguite con l’ausilio della medesima fotocamera, posta sul terzo occhio di un microscopio biologico Optech Biostar B5, supportato da ottiche Plan-APO, illuminazione alogena 12V-50 W a luce riflessa, con regolatore d'intensità. Le collezioni sono conservate nell'erbario A.M.B. Gruppo di Muggia e del Carso.
Dati di raccolta e Habitat
N. scheda: 5058. Data di ritrovamento: 09/05/2013. Località: Bosco di Riano. Comune: Rocca Santa Maria. Coordinate geografiche: 339; III; TERAMO. Altezza slm: f. 3. Habitat: A terra, tra muschio Polytrichum sp. Determinatore: Zugna M. Legit: de Ruvo B. Data inserimento in erbario: 07/06/2013.
Osservazioni
Le caratteristiche macro e micro morfologiche riportano alla specie in questione.
Bibliografia.
Bas, C., Kuyper, Th.W., Noordeloos, M.E. & Vellinga, E.C. (eds) (1999). Flora Agaricina Neerlandica 4. Strophariaceae, Tricholomataceae (3). Rotterdam: Balkema. 191 pp.
Breitenbach J. & Kränzlin F., 1995- Champignons de Suisse. Tome 4. Champignons à lames 2ème partie. Luzern, 371 pp.
Cetto B., 1975-1993 - 1 funghi dal vero. Trento. Taav. 1-3042.
Courtecuisse R. & Duhem B., 1994 - Les Champignons de France. Paris, 448 PP.
Index Fungorum: http://www.indexfung...Names/Names.asp
Kühner R., Romagnesi H., 1953 - Flore Analytique des Champiognons supérieurs. Paris, 556 pp.
Kühner R., Romagnesi H., 1954-1958 - Compléments à la "Flore Anayique". [Reprint: Biblioth. Mycol. 1977, 56: 484 pp.].
Moser M., 1983 – Guida alla determinzione dei funghi (Polyporales, Boletales, Agaricales, Russulales). In: Gams W., Kleine Kryptogamenflora Band lib/2. Stuttgart, 553pp.
Watling, R. & Gregory, N.M. (1987). British Fungus Flora. Agarics and Boleti 5. Strophariaceae and Coprinaceae p.p.: Hypholoma, Melanotus, Psilocybe, Stropharia, Lacrymaria and Panaeolus. Edinburgh: Royal Botanic Garden. 121 pp.
Photo by: Bruno de Ruvo
Photo by: Bruno de Ruvo
Photo by: Bruno de Ruvo



 This topic is locked
This topic is locked