Agrocybe dura (Bolton) Singer, Beih. bot. Cbl., Abt. B 56: 165 (1936)
Basionimo: Agaricus durus Bolton, Hist. fung. Halifax (Huddersfield) 2: 67, pl. 67 (1788)
Sinonimi: Agaricus durus Bolton, Hist. fung. Halifax (Huddersfield) 2: 67, pl. 67 (1788)
Hylophila dura (Bolton) Quél., Flore mycologique de la France et des pays limitrophes: 97 (1888)
Pholiota dura (Bolton) P. Kumm., Führ. Pilzk. (Zwickau): 84 (1871)
Togaria dura (Bolton) W.G. Sm., Syn. Brit. Basidiomyc.: 123 (1908)
Agrocybe dura var. xanthophylla (Bres.) P.D. Orton, Trans. Br. mycol. Soc. 43(2): 174 (1960)
Agrocybe molesta var. xanthophylla (Bres.) Bon & Courtec., Docums Mycol. 18(no. 69): 37 (1987)
Pholiota dura var. xanthophylla Bres., Fung. trident. 2: 52 (1892)
Agaricus molestus Lasch, Linnaea 3: 421 (1828)
Agaricus molestus Lasch, Linnaea 3: 421 (1828) var. molestus
Agrocybe molesta (Lasch) Singer, Sydowia 30(1-6): 197 (1978) [1977]
Agaricus vermifluus Peck, (1903)
Agrocybe vermiflua (Peck) Watling, Kew Bull. 31(3): 592 (1977)
Pholiota vermiflua (Peck) Sacc., Syll. fung. (Abellini) 5: 739 (1887)
Posizione sistematica: Strophariaceae, Agaricales, Agaricomycetidae, Agaricomycetes, Agaricomycotina, Basidiomycota, Fungi
Descrizione macroscopica della raccolta
Pileo 30-40 mm, all’inizio emisferico quindi convesso, infine piano-convesso, con o senza basso e largo umbone ottuso, margine intero, non striato, con persistenti residui velari al bordo. Cuticola viscosetta con l’umido, glabra con il secco, non igrofana, areolata e screpolata nella porzione discale, liscia in periferia. Di colore beige, biancastra nelle screpolature con l’età tendente a scurire su toni ocra giallastri, più intensi nella porzione discale.
Lamelle da adnate a smarginate, ventricose, sottili, mediamente fitte, inframezzate da 2-3 lamellule di diversa lunghezza, all’inizio ocraceo-grigiastre, infine rugginose, filo finemente crenulato, concolore o leggermente più chiaro delle facce.
Stipite 40-50 x 4-6 mm, da cilindrico a leggermente svasato all’apice, base lievemente ristretta o di pari spessore, in un caso allargata in un piccolo bulbo largo 8,5 mm; finemente pruinoso all’apice, longitudinalmente striato e fibrilloso, soprattutto nella porzione superiore; concolore al pileo, leggermente più scuro nella parte inferiore o dove manipolato; farcito all’interno.
Velo parziale, visibile soprattutto sul bordo pileico sotto forma di lembi biancastri, percettibile nella porzione superiore dello stipite sotto forma di lievi residui araneosi biancastri, tendenti all’ocra con la sporulazione.
Carne biancastra-beige nell’intero basidioma, giallina nella corteccia stipitale, ocracea o appena rugginosa nelle zone attaccate dalle larve. Consistenza soffice nel pileo, leggermente più fibrosa nello stipite. Odore lieve, appena farinaceo. Sapore gradevole, non farinaceo, dolce.
Sporata non effettuata.
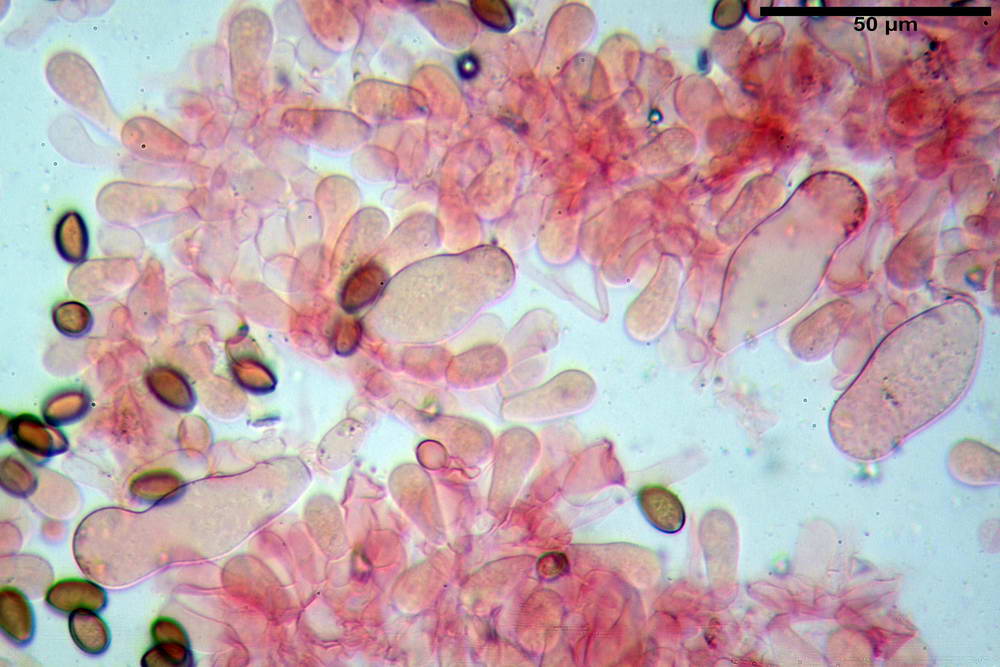
Descrizione microscopica della raccolta
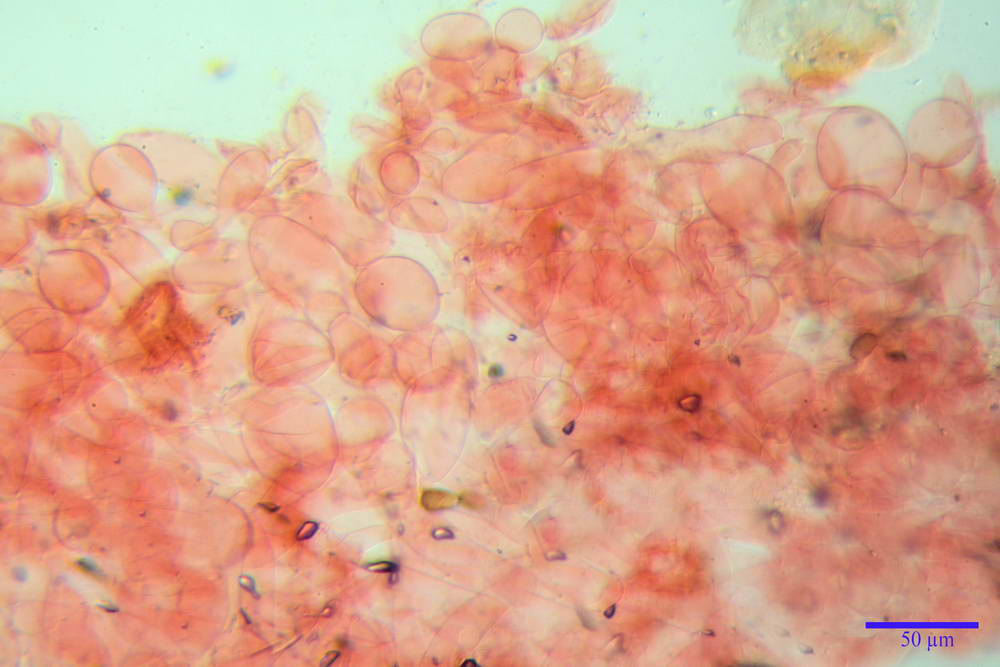
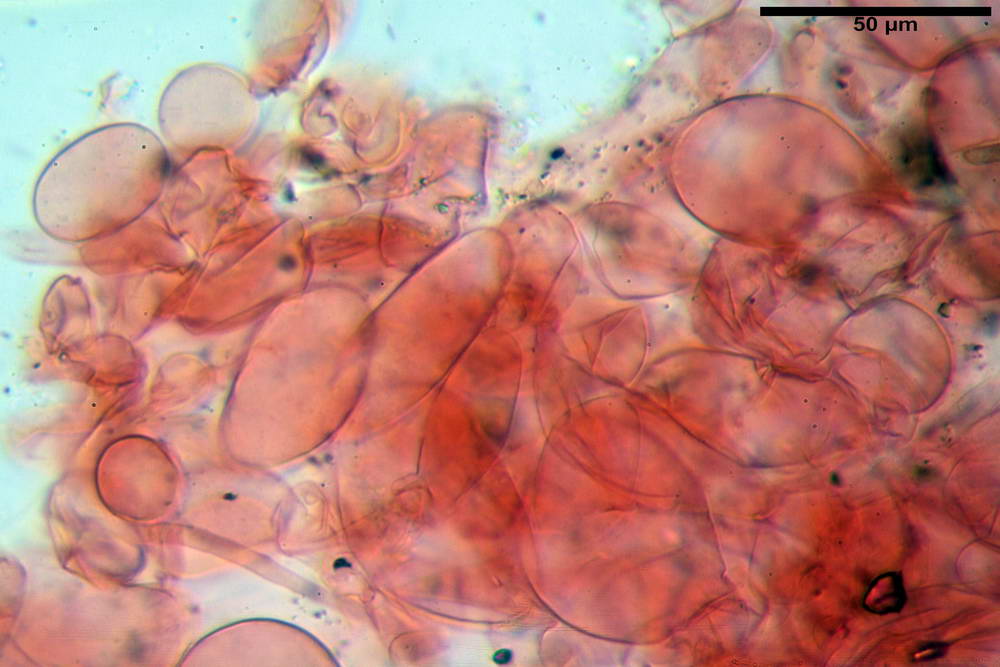
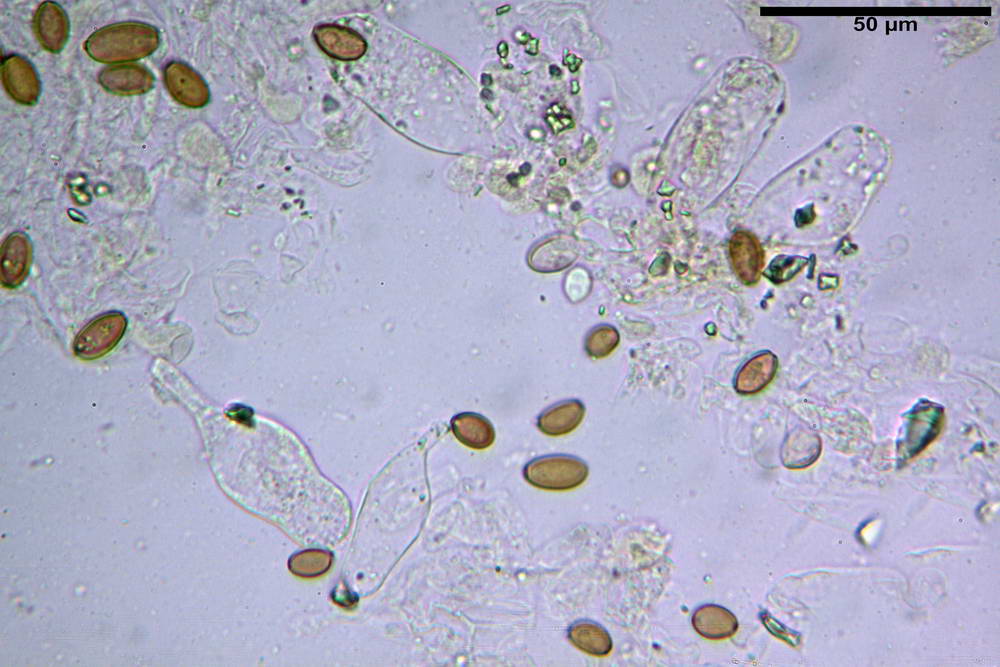
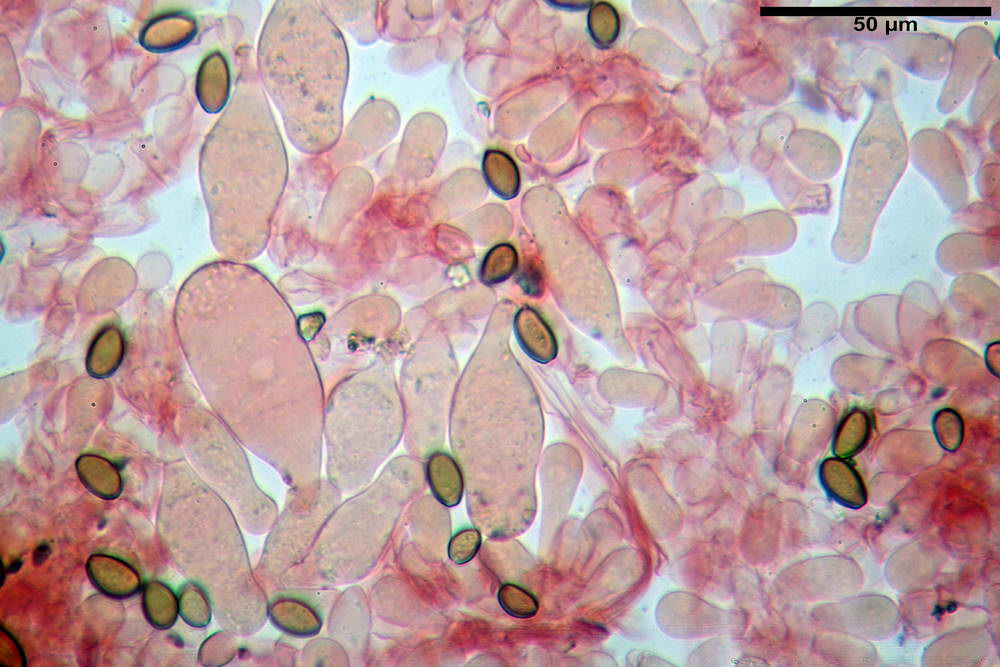
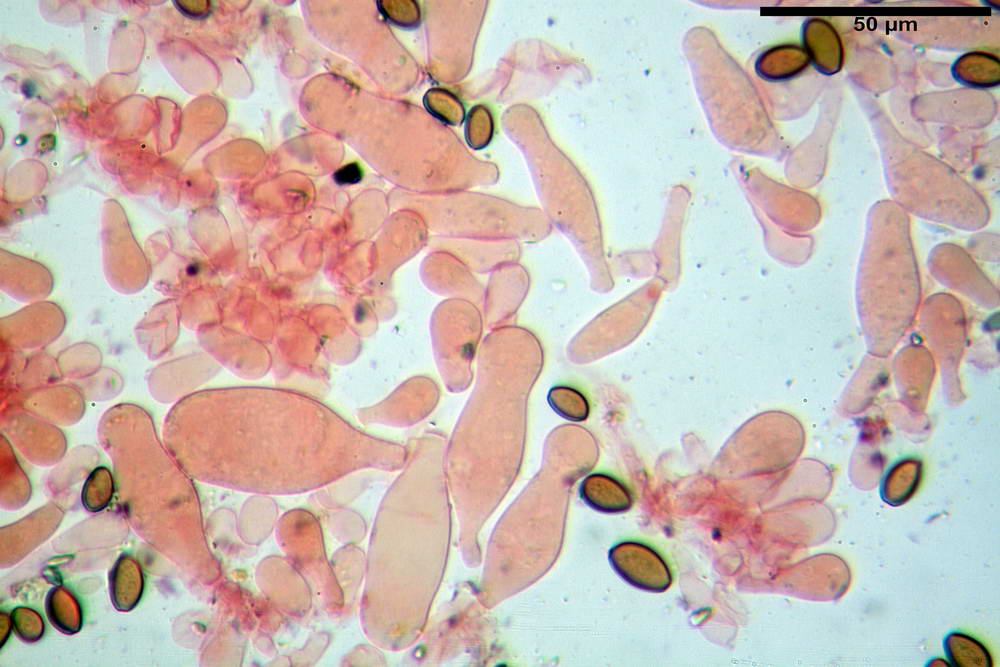
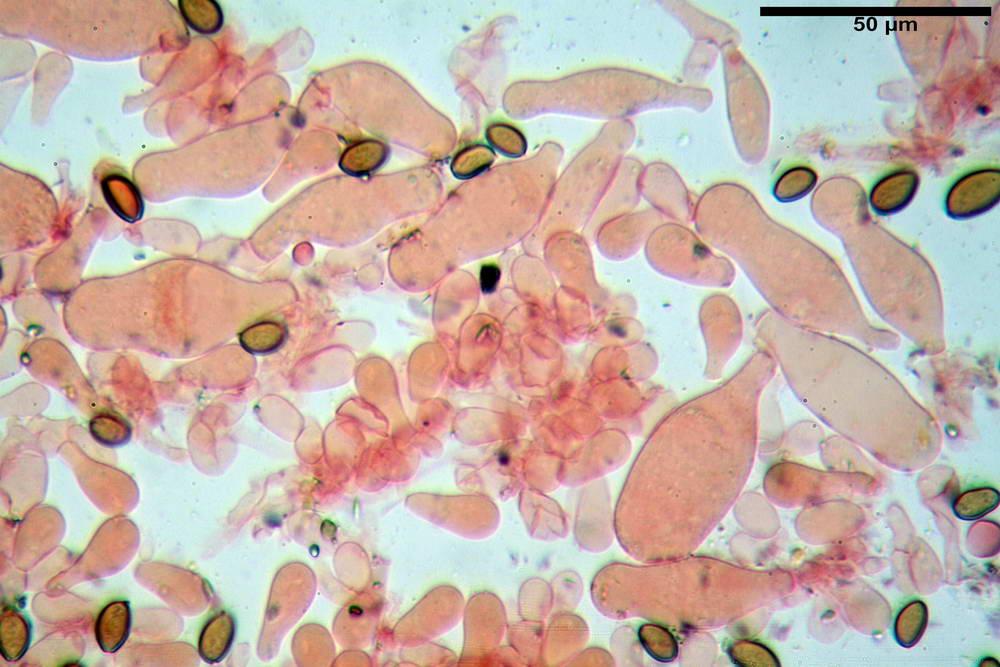
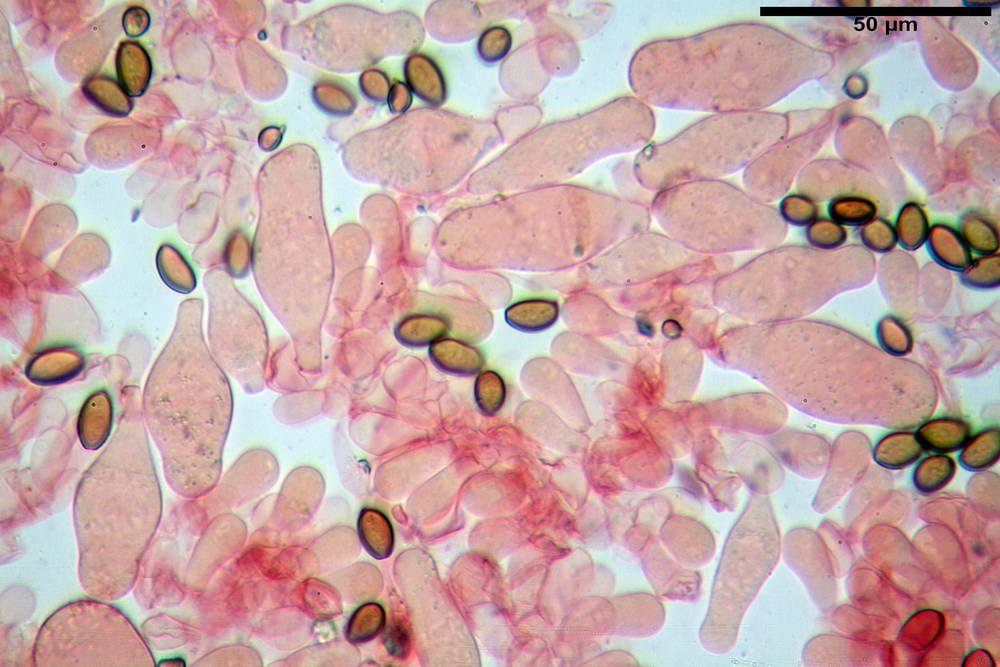
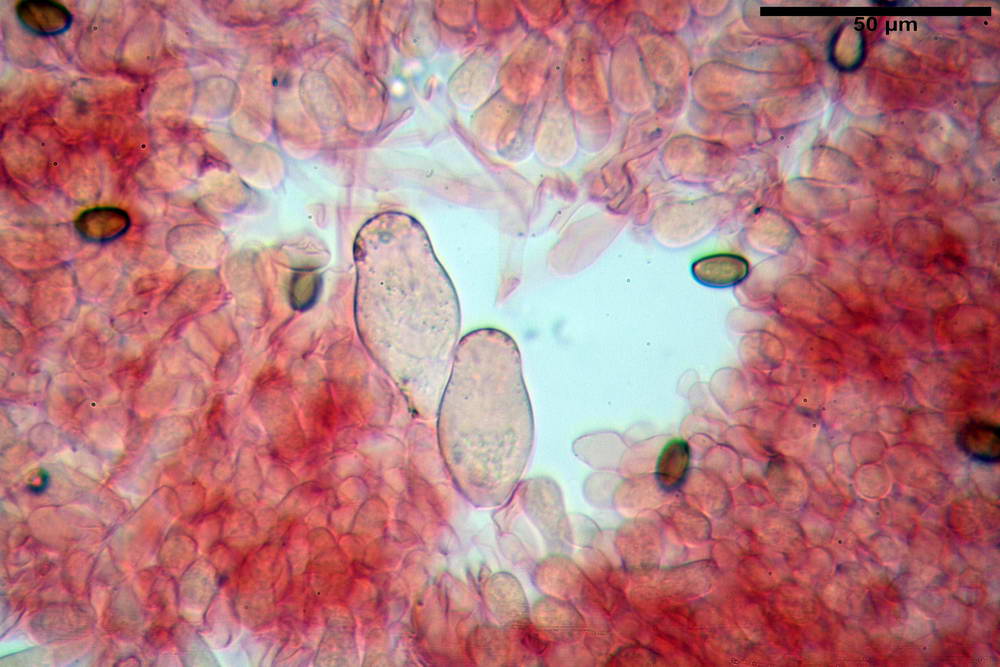
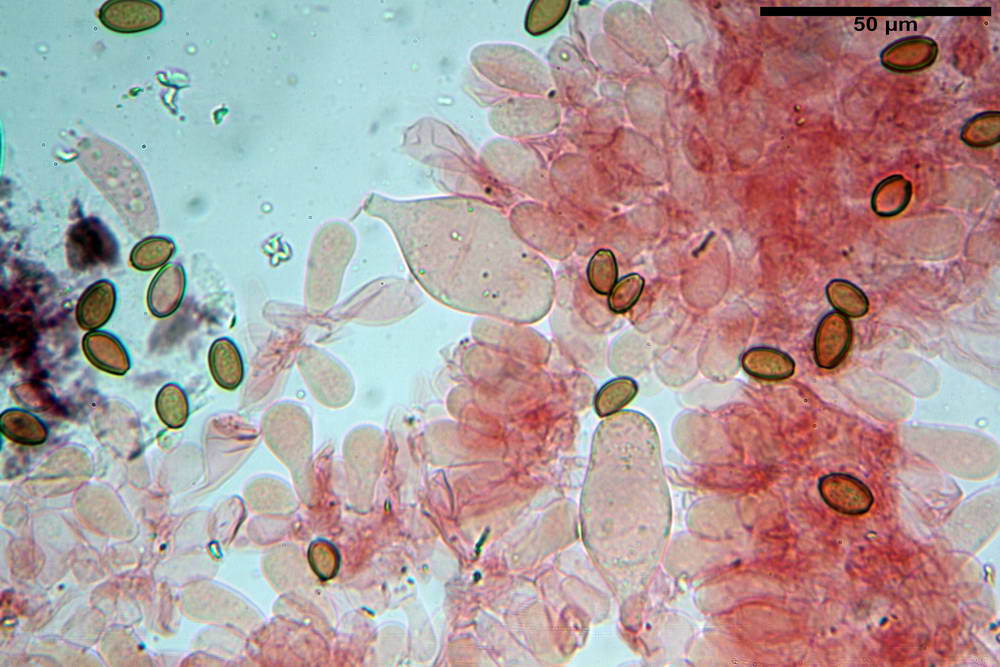
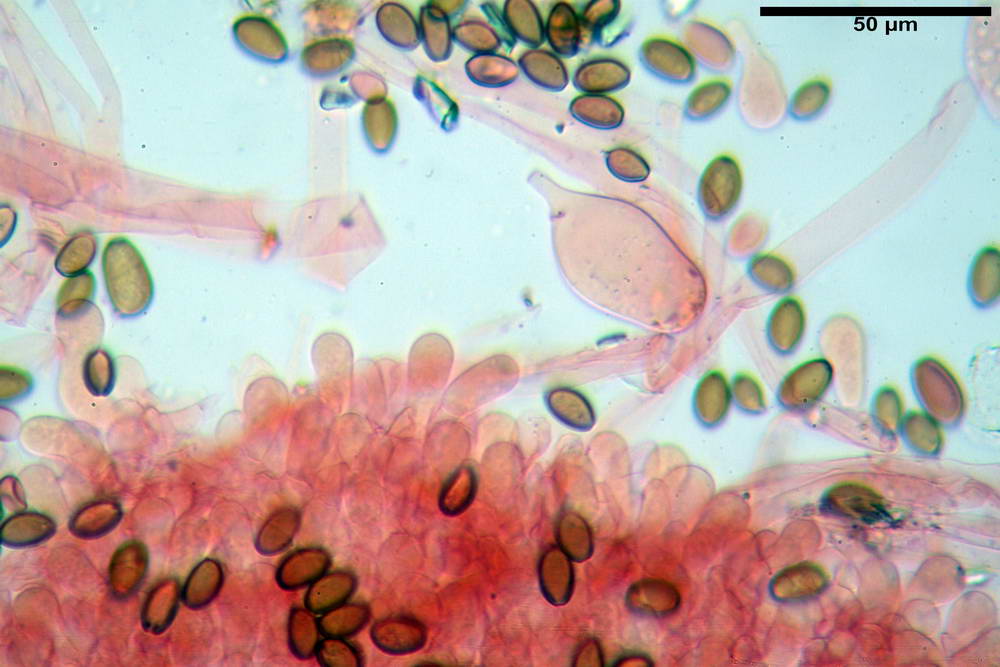
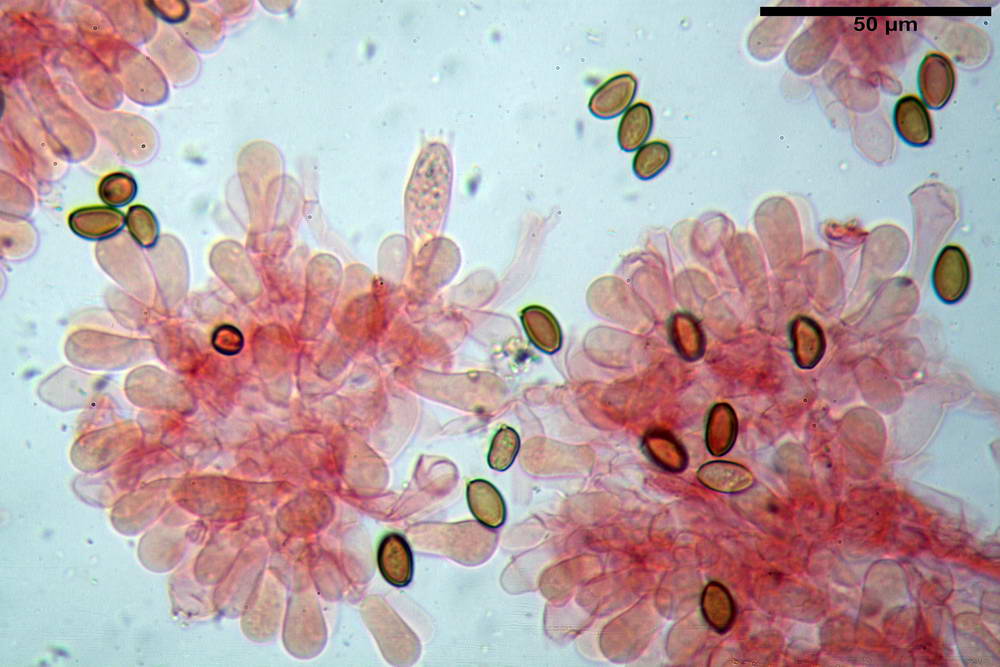
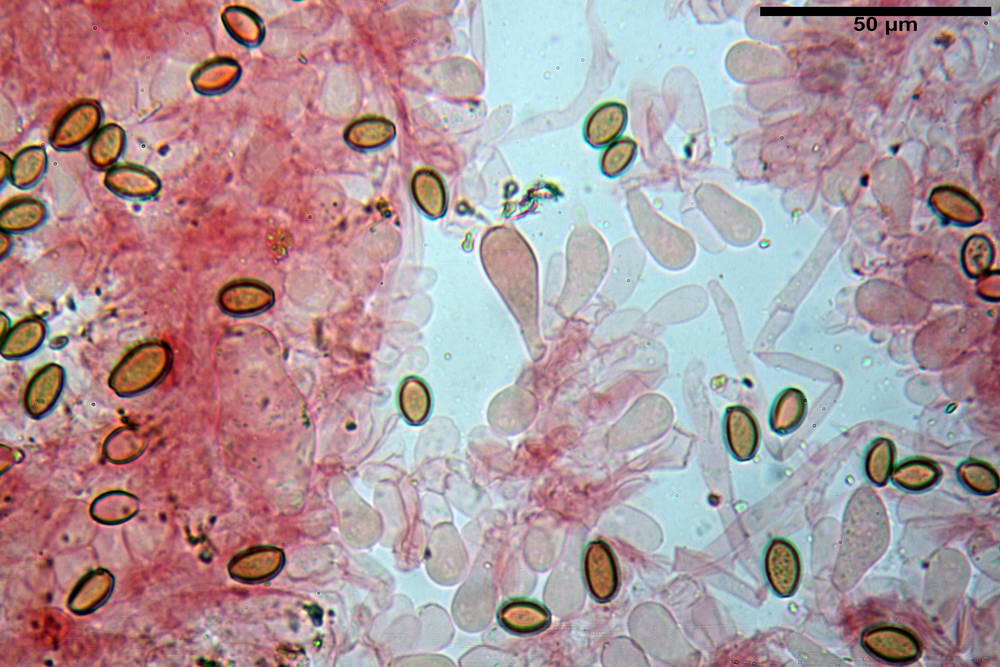
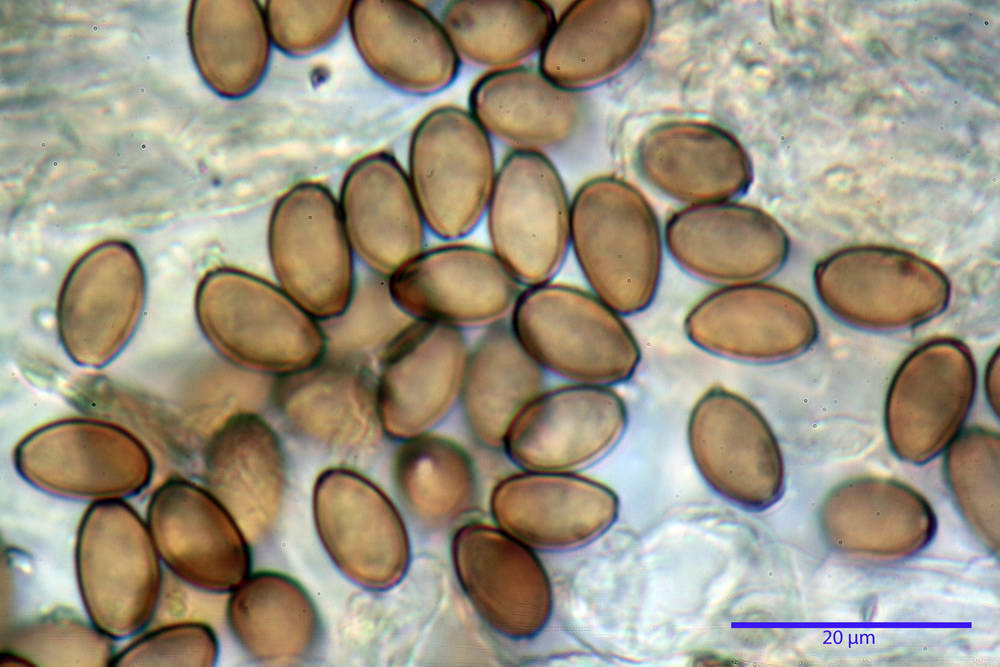
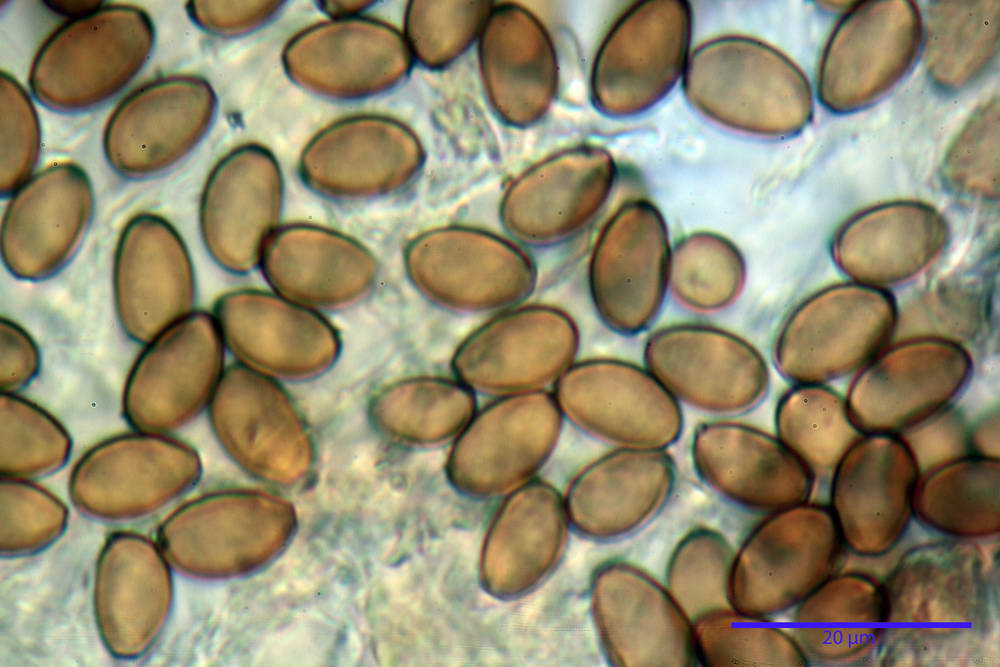
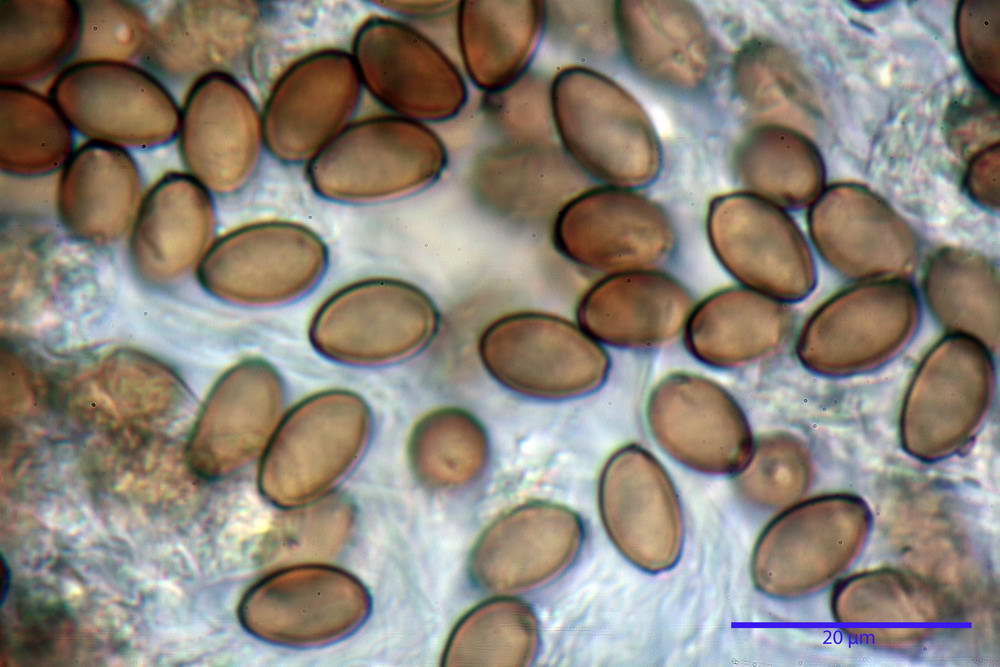
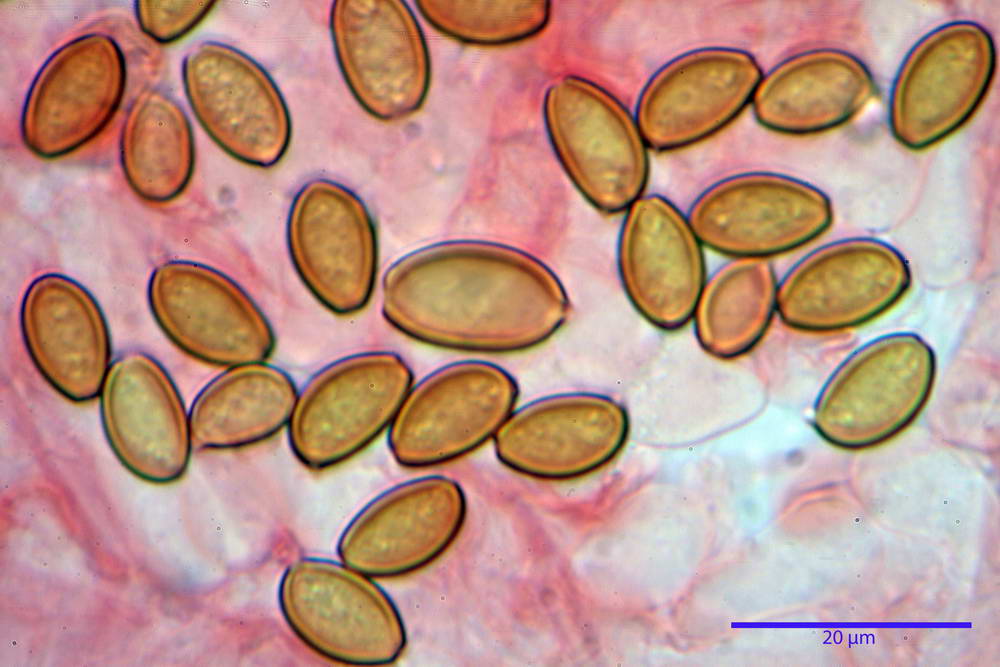
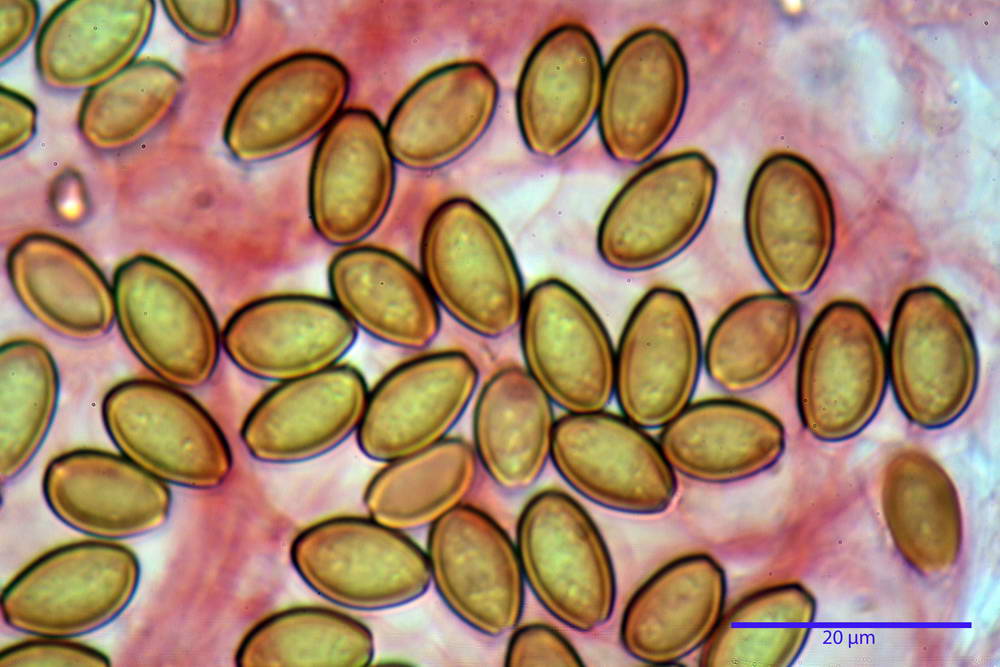
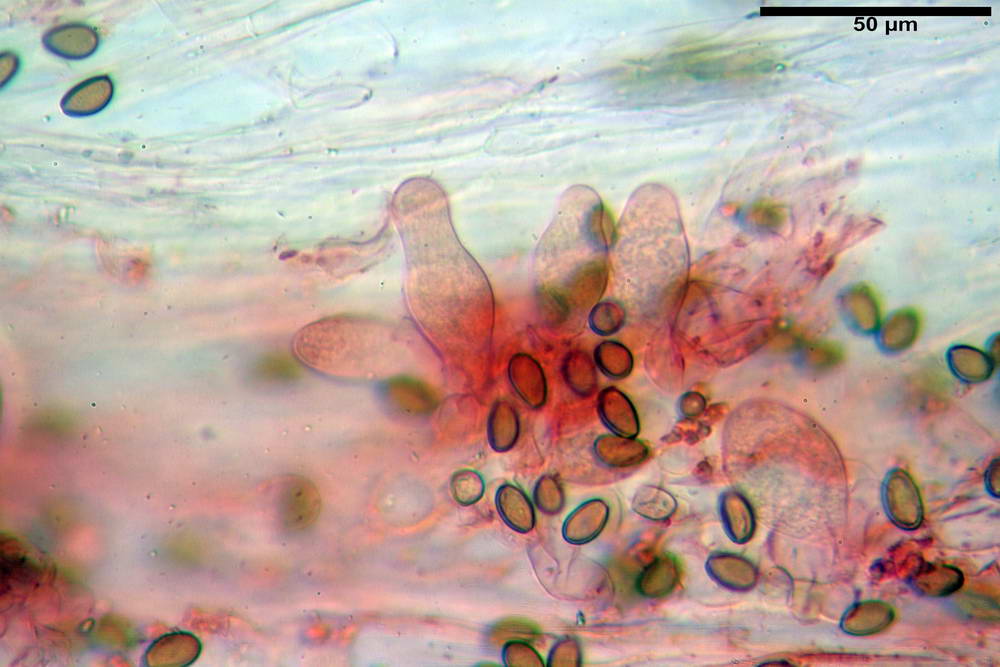
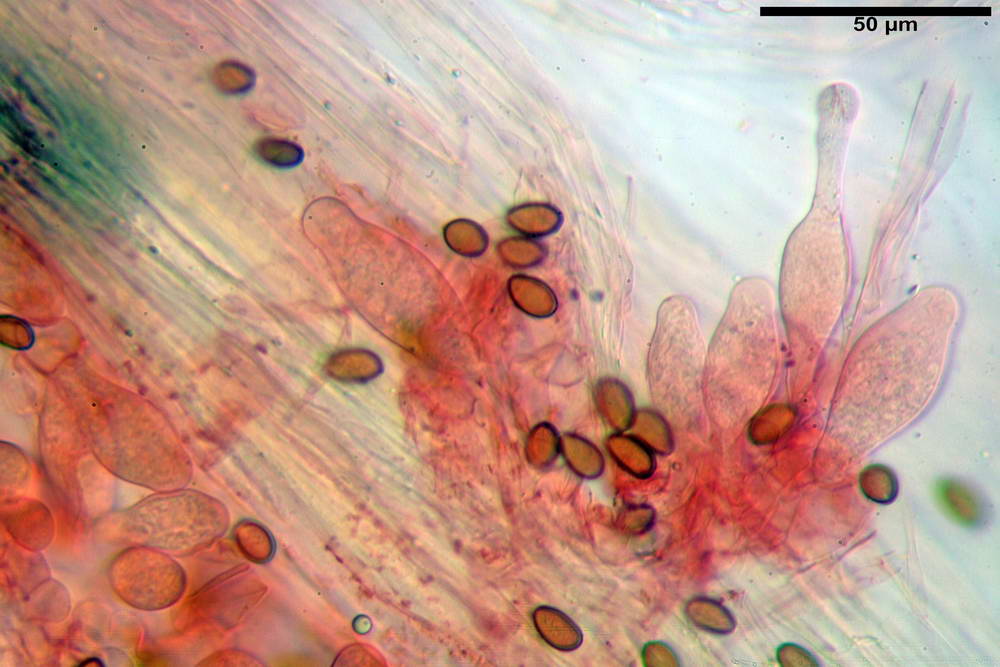
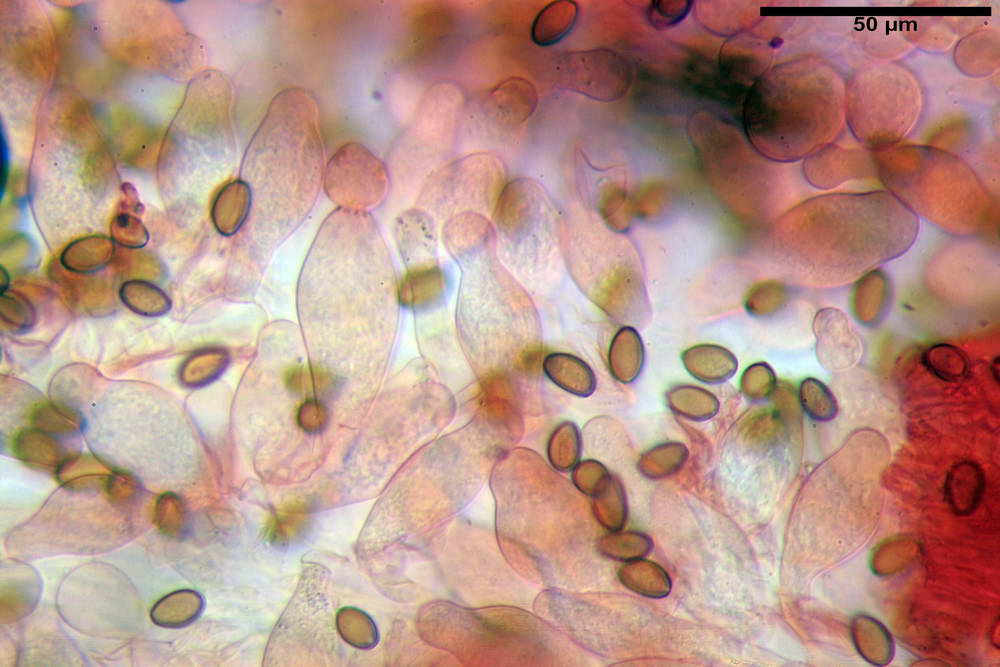
Spore (10,2) 10,8- 11,07 -12,0 (13,2) x (6,2) 6,5- 6,78 -7,1 (7,8) µm, Q. = (1,4) 1,5- 1,65 -1,7 (1,8); Vol. (227) 244- 251 -325 (371) µm³; da ellittiche a subamigdaliformi in proiezione laterale, sa strettamente ovoidi a ellissoidi in proiezione frontale, lisce, ocra brunicce in H2O, parete sporale 0,8-1,3 µm, poro germinativo 0,9-1,6 µm.
Basidi 22,2- 26,34 -31,3 x 9,3- 10,23 -11,6 µm; Vol.m = 1460 µm³; clavati, bisporici e monosporici, più raramente tetrasporici.
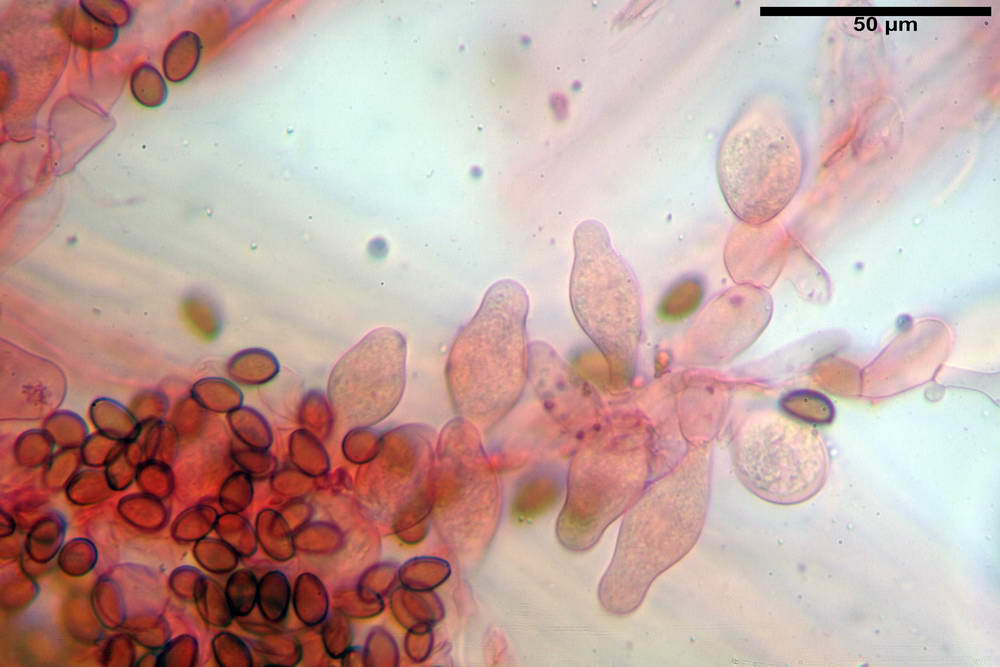
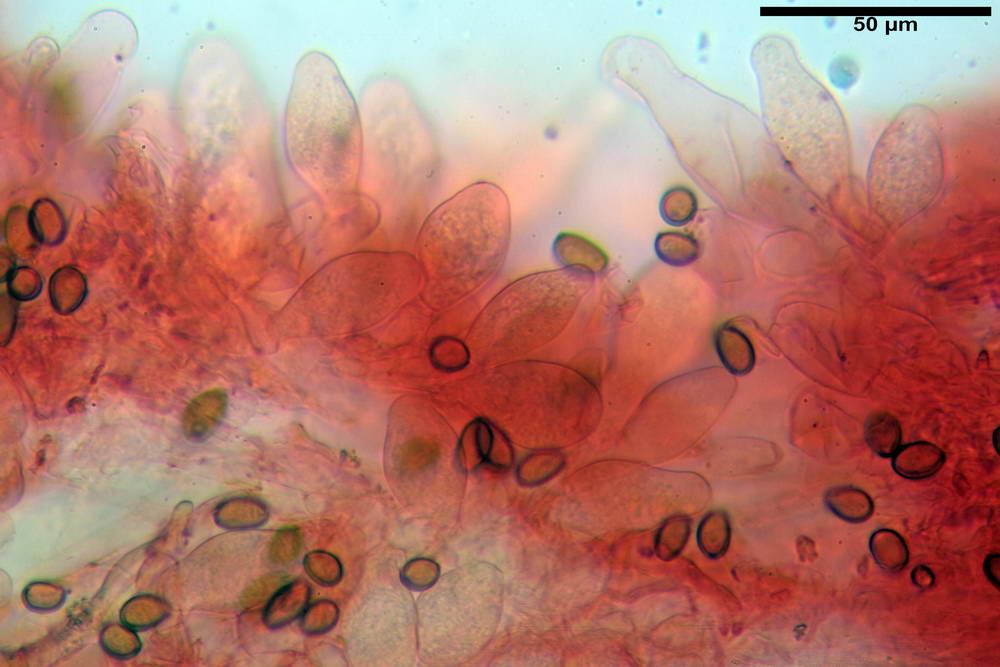
Cheilocistidi (26,4) 31,2- 34,78 -52,0 (56,2) x (9,5) 10,9- 13,68 -20,6 (24,5) µm; Vol.m = 5985 µm³; da oblunghi a strettamente o largamente utriformi, frammisti ad altri di tipologia subconica o largamente clavata, con contenuto leggermente giallastro, filo lamellare sterile.
Pleurocistidi (24,2) 30,7- 41,7 -47,6 (53,5) x (10,3) 14,2- 18,13 -23,0 (24,1) µm, Vol.m = 8154 µm³; da strettamente a largamente utriformi più o meno pedicellati, subfusiformi, poco abbondanti, con contenuto leggermente giallastro.
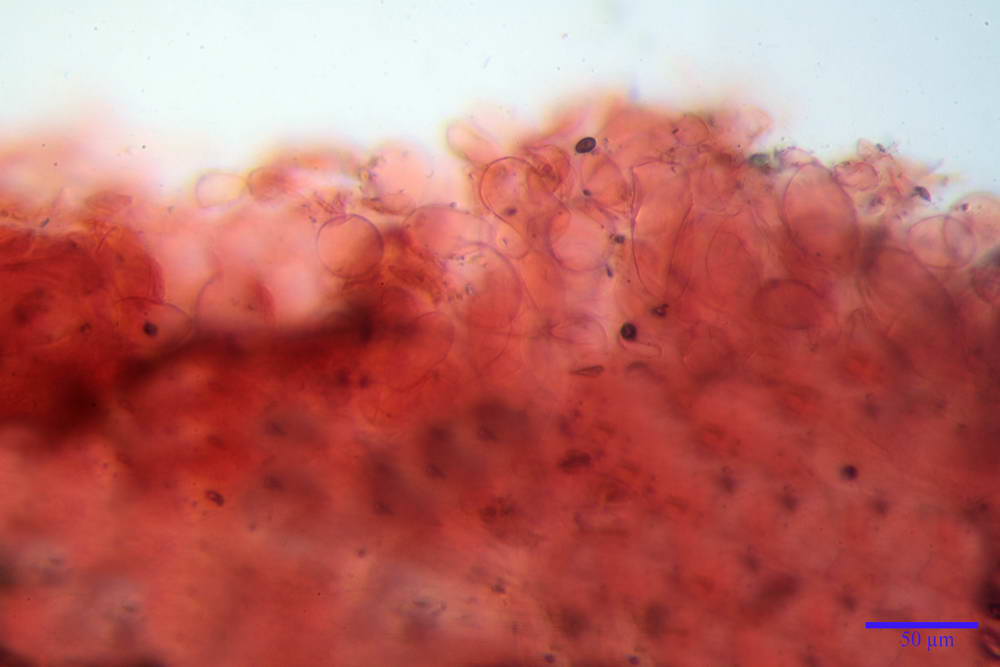
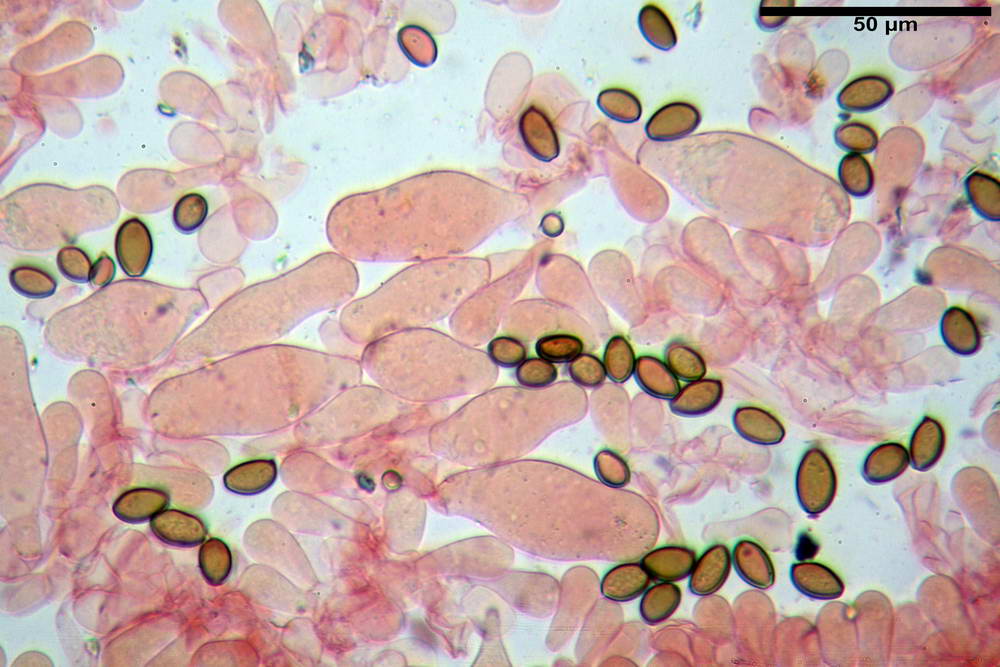
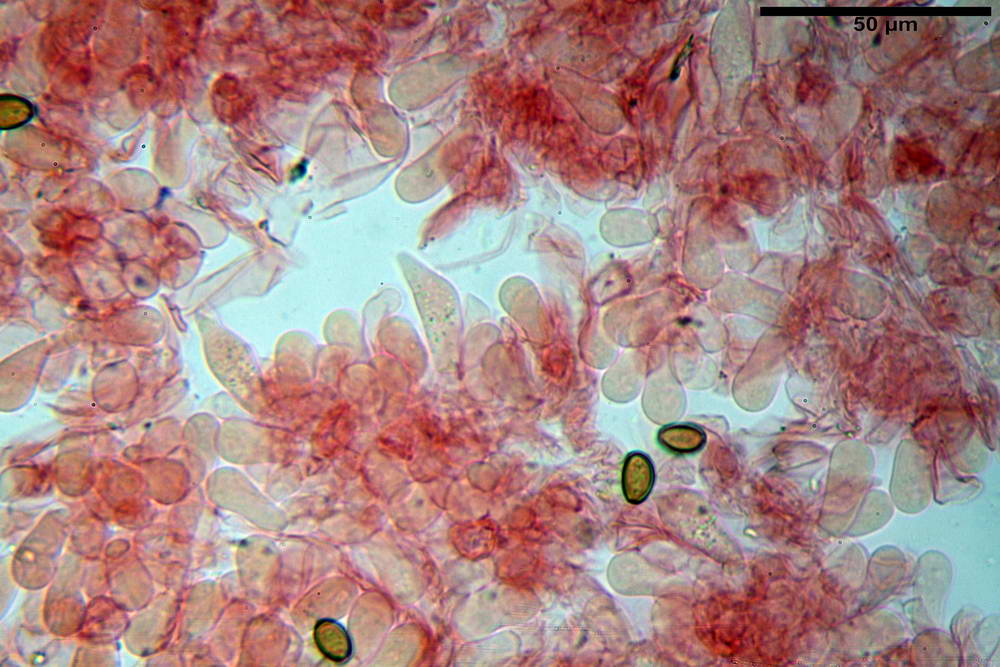
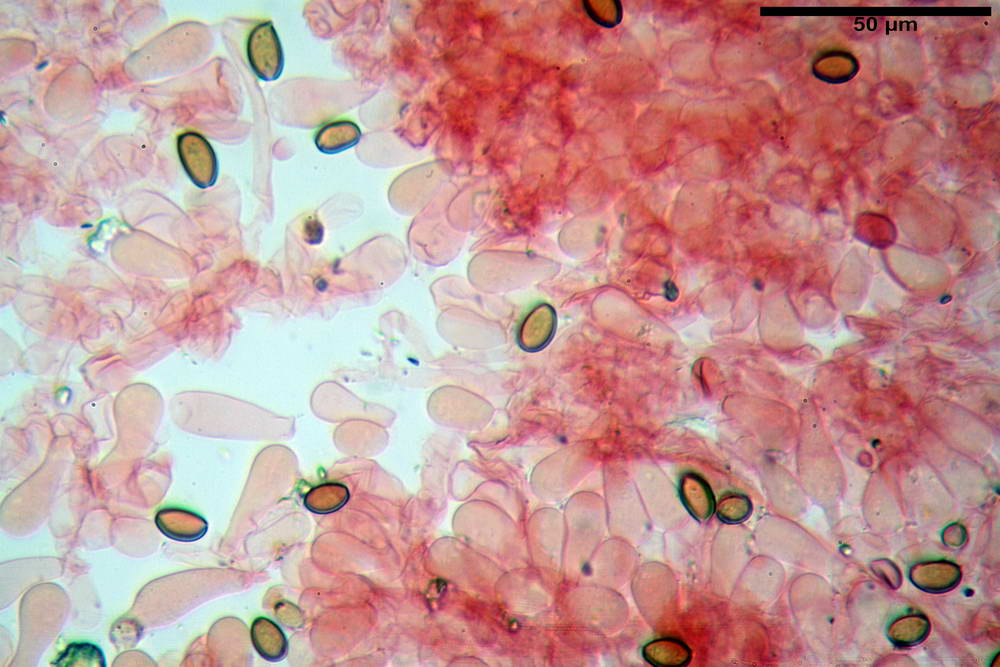
Pileipellis di tipo imeniderma, formato da cellule gelatinizzate, a tipologia principalmente clavata o piriforme, misuranti (31,5) 31,9- 41,52 -63,0 (63,7) x (20,9) 24,0- 30,79 -38,8 (39,1) µm, Vol.m = 24662 µm³. Pileocistidi non osservati.
Subpellis formata da una serie di cellule subisodiametriche.
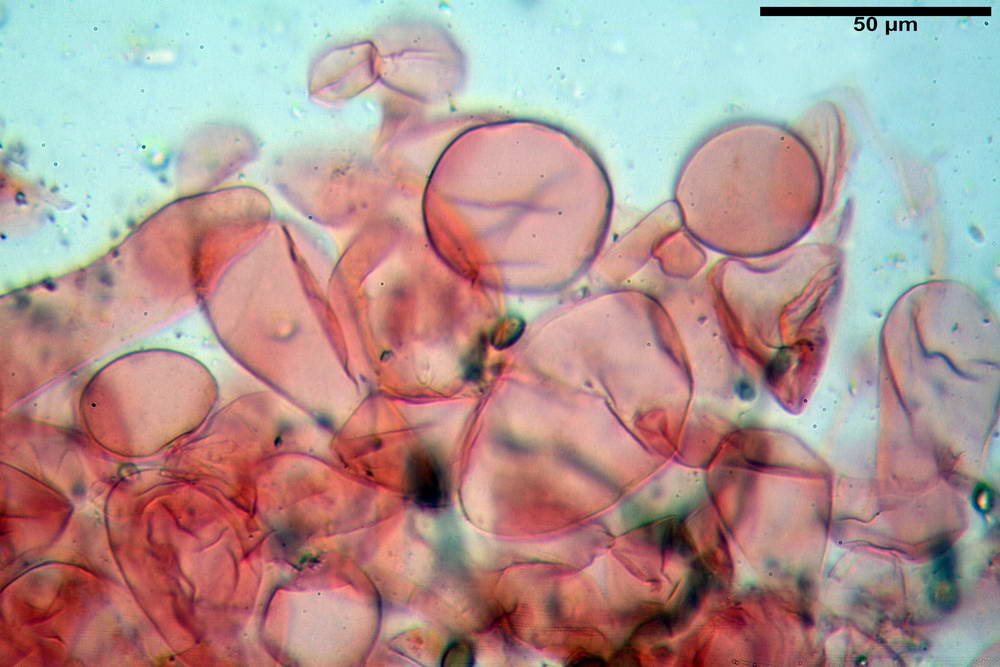
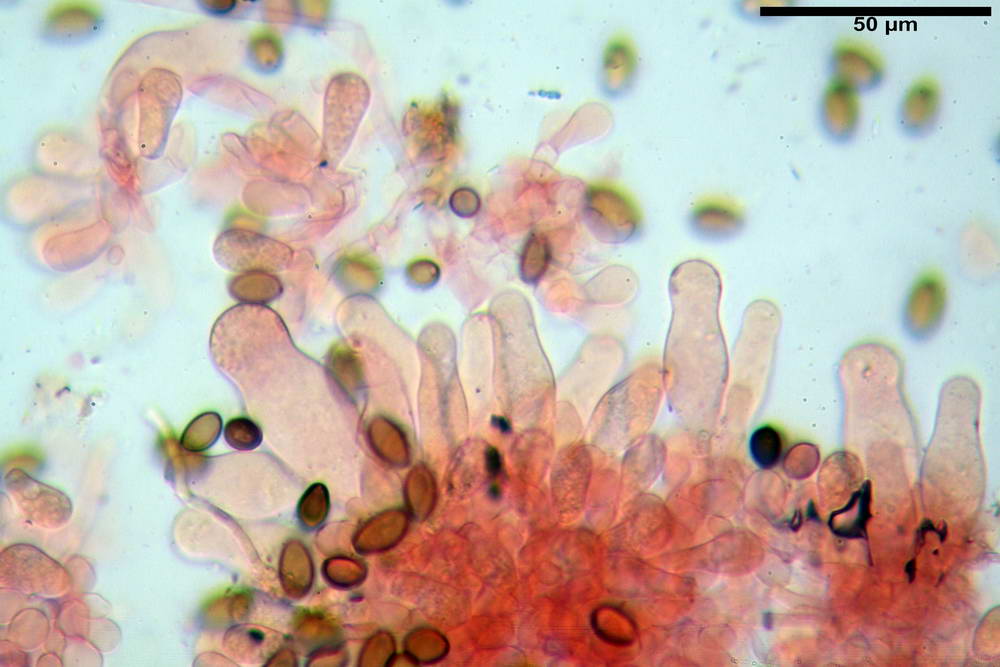
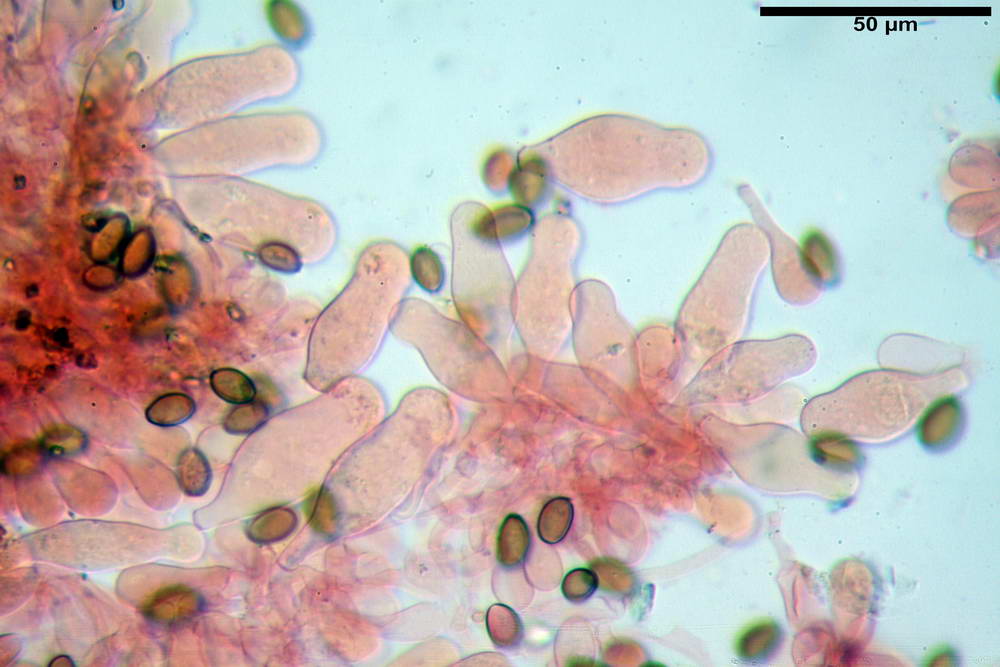
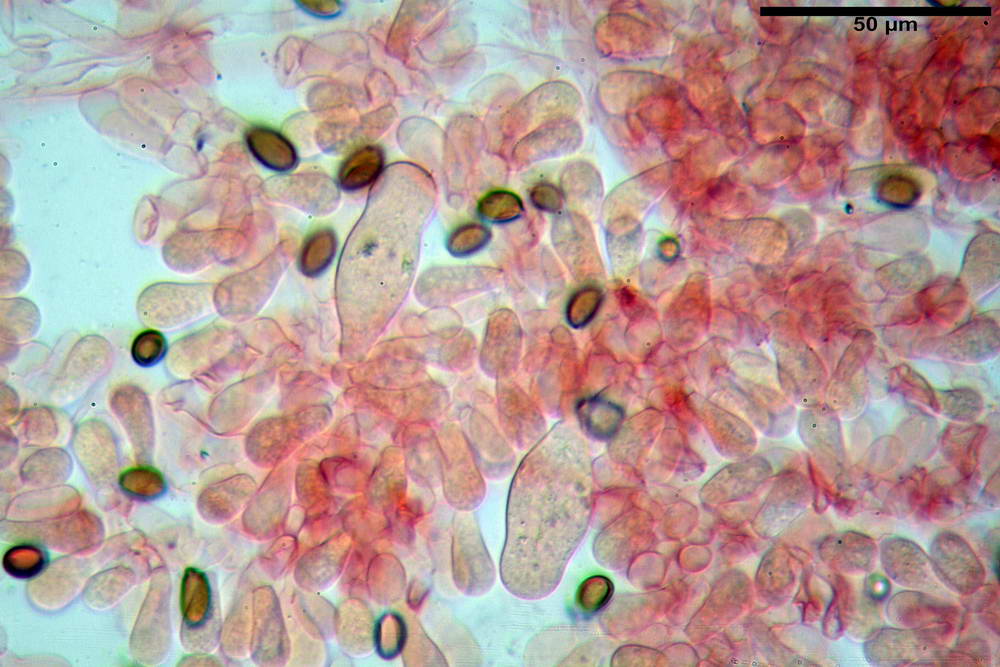
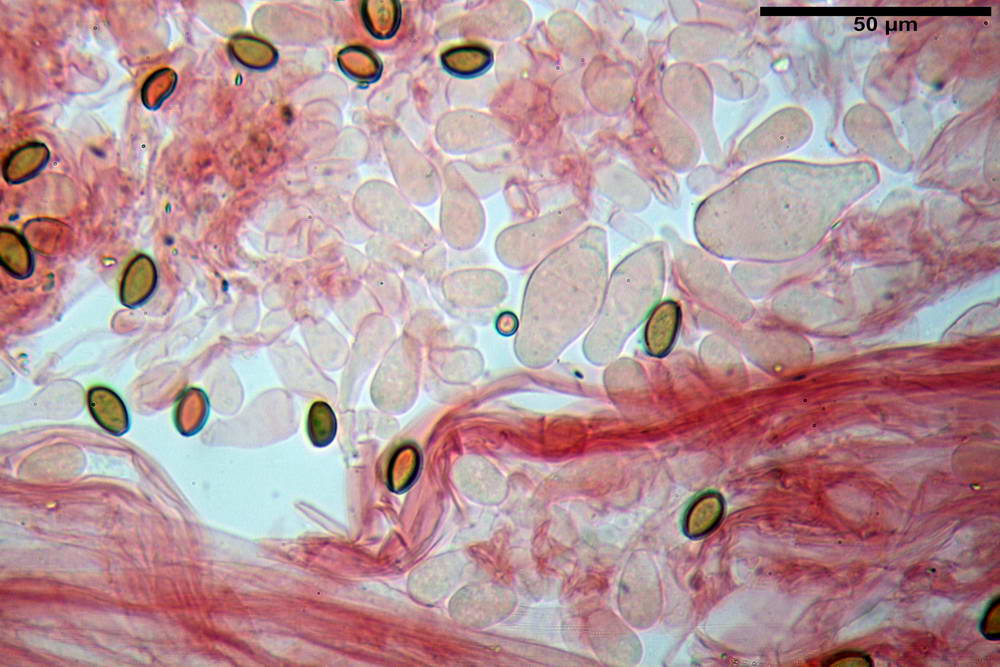
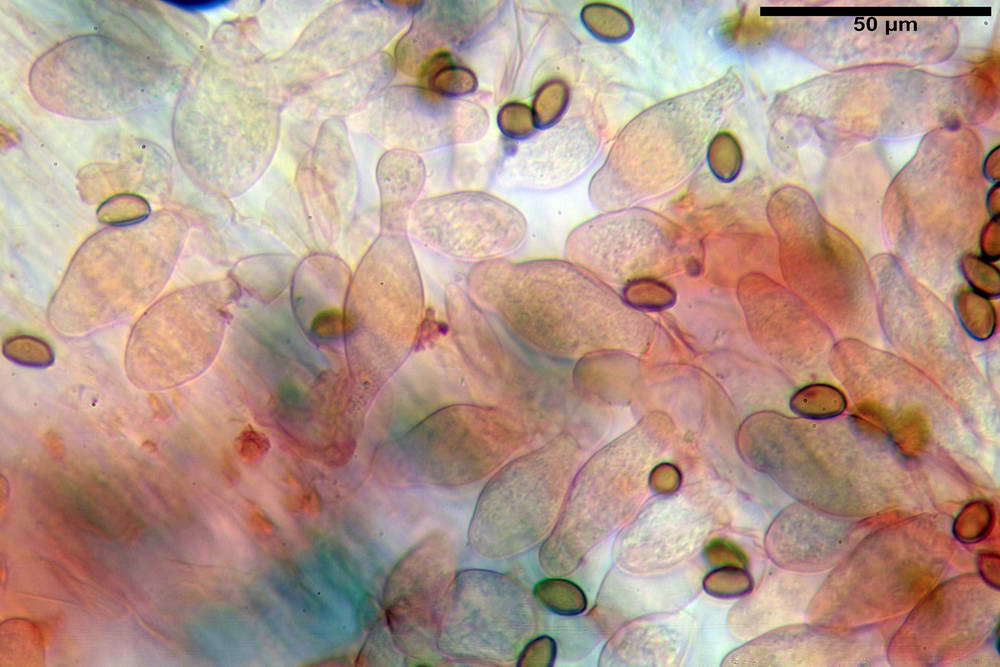
Stipitipellis tipo cutis, formata da ife cilindriche, ialine o con lieve pigmento giallastro, gelatinizzate, misuranti (4,1) 4,2-7,3 (8,1) µm.
Caulocistidi (26,5) 30,7- 31,08 -52,0 (72,2) x (10,9) 14,3- 14,84 -20,9 (23,5) µm, Vol.m = 6821 µm³, strettamente o largamente utriformi, frammisti ad altri di tipologia subconica o largamente clavata, in alcuni rari casi lageniformi, ialini o con contenuto leggermente giallastro, a mucchietti densamente appressati nella porzione stipitale supranulare. Non osservati ella porzione subanulare.
Giunti a fibbia presenti in tutti i tessuti osservati.
Materiali e metodi di studio
La descrizione macroscopica è stata eseguita su materiale fresco, lo studio microscopico sia su materiale fresco che secco, reidratati e osservati in H2O, KOH 2%, NH4OH 6%, Rosso Congo anionico. Le misure microscopiche sono state eseguite con il software di calcolo Mycométre gentilmente fornitoci dal Sig. Georges Fannechère e prelevabile a questo indirizzo http://mycolim.free.fr. Le misure sporali si riferiscono a 100 unità, effettuate in proiezione laterale e senza tener conto dell’apiculo, prelevate da zone non imeniali, scartando spore ancora evidentemente immature. Le misure sottolineate si riferiscono alle medie. Per le rimanenti tipologie cellulari si sono eseguite un minimo di venti misure a tipologia. Per la terminologia riguardante la tipologia delle caratteristiche macro e microscopiche, si fa riferimento a Else C. Vellinga1998: Flora Agaricina Neerlandica 1- Chapter 8; Glossary. Per quanto riguarda la nomenclatura aggiornata ed i nomi degli Autori, abbiamo fatto riferimento a http://www.indexfung...names/Names.asp e http://www.mycobank.org/MycoTaxo.aspx. Per le osservazioni dei caratteri macroscopici, in alcuni casi, ci siamo valsi di uno stereo microscopio Optech trinoculare e del supporto di foto macro ad alta risoluzione. Le foto macro sono state effettuate in laboratorio, con l’ausilio di una fotocamera Reflex Canon EOS 50D + obiettivo Canon EF 100mm f/2.8 Macro USM. Le foto concernenti la microscopia, sono state eseguite con l’ausilio della medesima fotocamera, posta sul terzo occhio di un microscopio biologico Optech Biostar B5, supportato da ottiche Plan-APO, illuminazione alogena 12V-50 W a luce riflessa, con regolatore d'intensità. Le collezioni sono conservate nell'erbario A.M.B. Gruppo di Muggia e del Carso.
Dati di raccolta e Habitat
N. scheda: 5044. Data di ritrovamento: 13/05/2013. Località: Basovizza. Comune: Hrpelie (SLO). Coordinate geografiche: 45°39'37.62"N 13°52'56.99"E. Altezza slm: 389. Habitat: Prateria carsica. Determinatore: Zugna M. Legit: Leric Juliana. Data inserimento in erbario: 17/05/2013.
Osservazioni
Parte della bibliografia sui generis da noi consultata (Nauta 2005), segnala, per buona parte delle specie, la presenza di terminali di poco differenziati dalle ife della stipitipellis. In Agrocybe aegerita, la loro totale assenza.
Per quanto riguarda le specie inserite nella Sezione Agrocybe, questo è quanto si riscontra in (Nauta 1987).
A. autumnalis, elementi terminali non differenziati.
A. paludosa, presenza di elementi terminali poco differenziati 17-42 x 2,5-4 µm.
A. praecox, presenza di elementi terminali inflati 25-30 x 6-9,5 µm.
A. dura, presenza di elementi terminali di forma clavata 40-50 x 13-22 µm.
Non ritenendo quindi, la forma dei caulocistidi, come possibile carattere di valore sistematico forte.
Per contro, in A. arvalis, A. Firma, A. pusiola e A. putaminum, inserite in differenti sezioni, si segnala la presenza di veri caulocistidi.
Da sottolineare che, nella raccolta in questione, abbiamo osservato la presenza di caulocistidi di forma tipica (da strettamente a largamente utriformi), cioè, simili a quelli imeniali. Per contro, in una raccolta da noi studiata in precedenza e determinata come Agrocybe dura, scheda erbario n° 4663 (un confronto al seguente indirizzo web) http://www.ambmuggia...+agrocybe +dura, i caulocistidi si sono rivelati di tipologia completamente differente.
In seguito a questa osservazione ci riproponiamo di controllare eventuali future raccolte di queste due specie, ed eventualmente verificare la costanza nelle forme riscontrate per avere un quadro più chiaro, onde poter segnalare quale delle due forme sia la più costante e magari dar forza ad un carattere sistematico che potrebbe essere d’aiuto a far luce sulle specie del praecox complex.
Bibliografia
Bon M. - 1980: Revision du Genre Agrocybe Fayod. Bulletin trimestriel de la Fédération Mycologique Dauphiné-Savoie, 76: 32-36.
Index Fungorum: http://www.indexfung...Names/Names.asp
Nauta M. M. - 1987: Revisie van de in Nederland voorkomende soorten van het geslacht Agrocybe (Leemhoeden). Rijksherbarium, Leiden.
Nauta M. M. - 2005: Flora Agaricina Neerlandica, vol. 6
Watling R. - 1982: British fungus flora, Agarics and Boleti. 3. Bolbitìaceae: Agrocybe, Bolbitius & Conocybe. Royal Botarne Garden. Edinburgh.
WATLING R. & BIGELOW H., 1983: Observations on the Bolbitiaceae - 22, in Mycotaxon XVII: 378-389



 Questa discussione è bloccata
Questa discussione è bloccata