Entoloma vernum S. Lundell, Svensk bot. Tidskr. 31: 193 (1937)
Basionimo : Entoloma vernum S. Lundell, Svensk bot. Tidskr. 31: 193 (1937)
Sinonimi: Entoloma cucullatum (J. Favre) Bon & Courtec., Docums Mycol. 18(no. 69): 38 (1987)
Entoloma cucullatum (J. Favre) Cetto, Enzyklopädie der Pilze, Band 2: Schnecklinge, Trichterlinge, Ritterlinge, Rötlinge, Wulstlinge u.a. (München): 567 (1987)
Entoloma cucullatum (J. Favre) M.M. Moser, Guida alla Determinazione dei Funghi, 1° Polyporales, Boletales, Agaricales, Russulales. Edn 2 (Trento): 221 (1986)
Nolanea cucullata (J. Favre) P.D. Orton, Trans. Br. mycol. Soc. 43(2): 179 (1960)
Nolanea verna (S. Lundell) Kotl. & Pouzar, Česká Mykol. 26: 221 (1972)
Rhodophyllus cucullatus J. Favre, Ergebn. wiss. Unters. schweiz. NatnParks 5(33): 62 (1955)
Rhodophyllus vernus (S. Lundell) Romagn., Bull. trimest. Soc. mycol. Fr. 63: 195 (1947)
Posizione sistematica: Entolomataceae, Agaricales, Agaricomycetidae, Agaricomycetes, Agaricomycotina, Basidiomycota, Fungi
Descrizione macroscopica della raccolta
Basidiomi di portamento micenoide, taglia da piccola a medio-piccola, carne esigua, crescita boschiva in aghifoglia e latifoglia, solitamente precoce, del tutto simile a E. hirtipes.
Pileo largo 20-40 mm, all'inizio conico-campanulato, successivamente campanulato, infine espanso con papilla centrale ben evidente, margine intero, a lungo involuto, appena leggermente striato per trasparenza con tempo umido. Igrofano. Rivestimento pileico glabro, innatamente fibrilloso, da lucido a leggermente untuoso con l'umido, colorazioni pileiche tendenzialmente brunastre intense a seconda del grado di umidità, da bruno-seppia a bruno-dattero; bruno-grigiastro con tempo secco, bruno-nerastro negli esemplari posti in exsiccata.
Lamelle da annesse a strettamente adnate, ventricose, manifestamente venate, inframezzate da 5-8 lamellule, in gioventù di colore crema-grigiastro, presto rosa-grigiastre, infine rosa-brunastre, filo lamellare concolore, finemente ondulato.
Stipite 30-50 x 3-6 mm, da cilindrico a svasato all'apice e leggermente allargato alla base, sostanzialmente grigiastro, pruinoso nella porzione apicale, ornato da striature fibrillose argentee disposte longitudinalmente fin quasi alla base, ricoperto da un tomento bambagioso di colore bianco nella porzione basale, di aspetto esile, facilmente fratturabile, da giovane pieno ma presto cavo.
Carne esigua, acquosa, di colore bruno-grigiastro. Odore nullo. Sapore non testato nel fresco, rancido nell'exsiccata.
Descrizione microscopica della raccolta
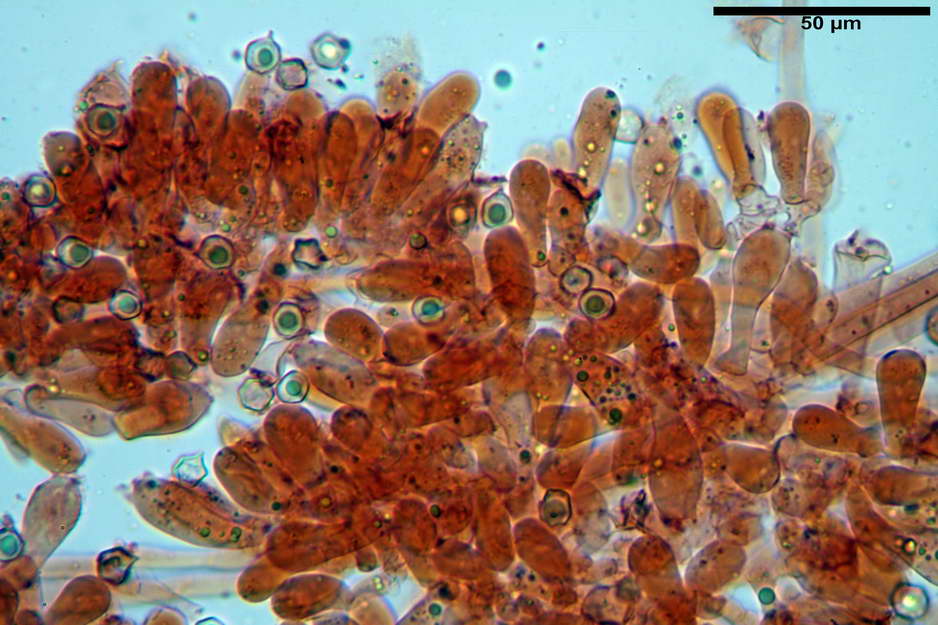
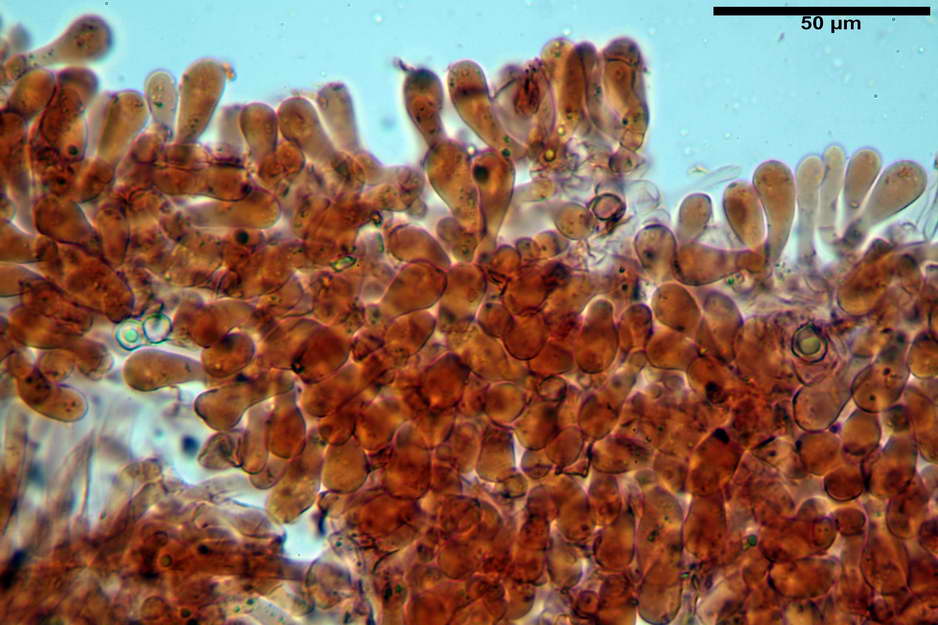
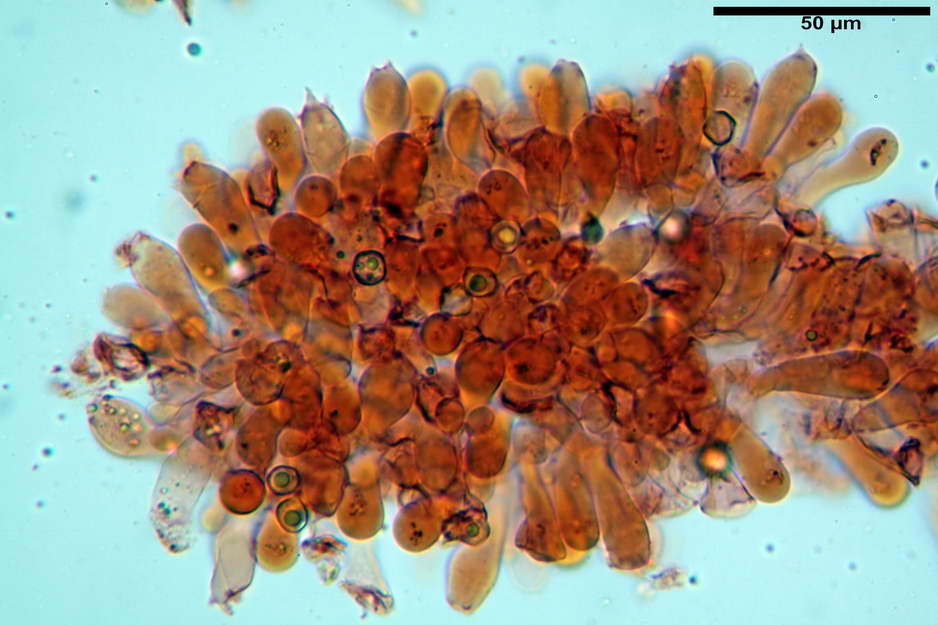
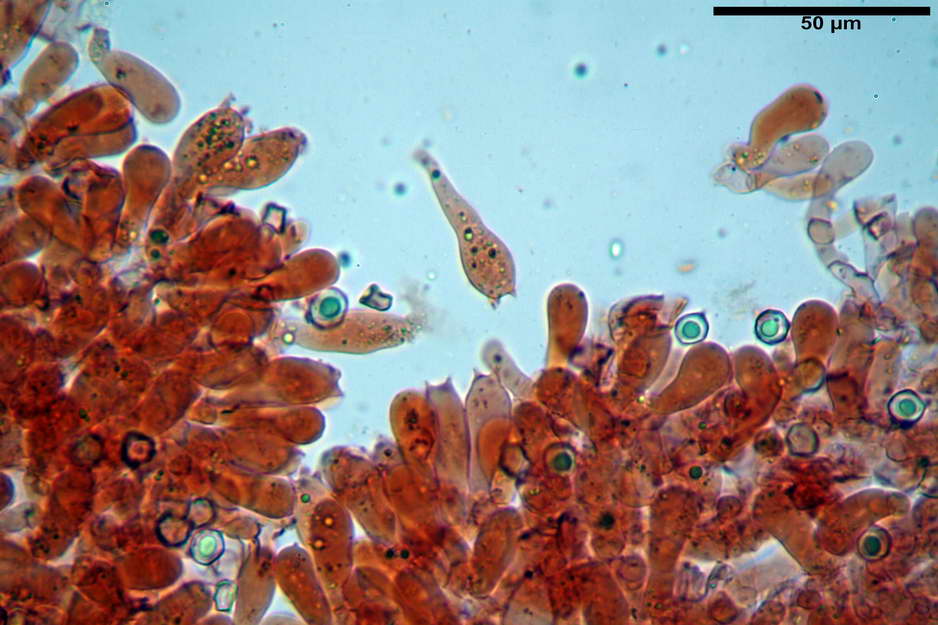
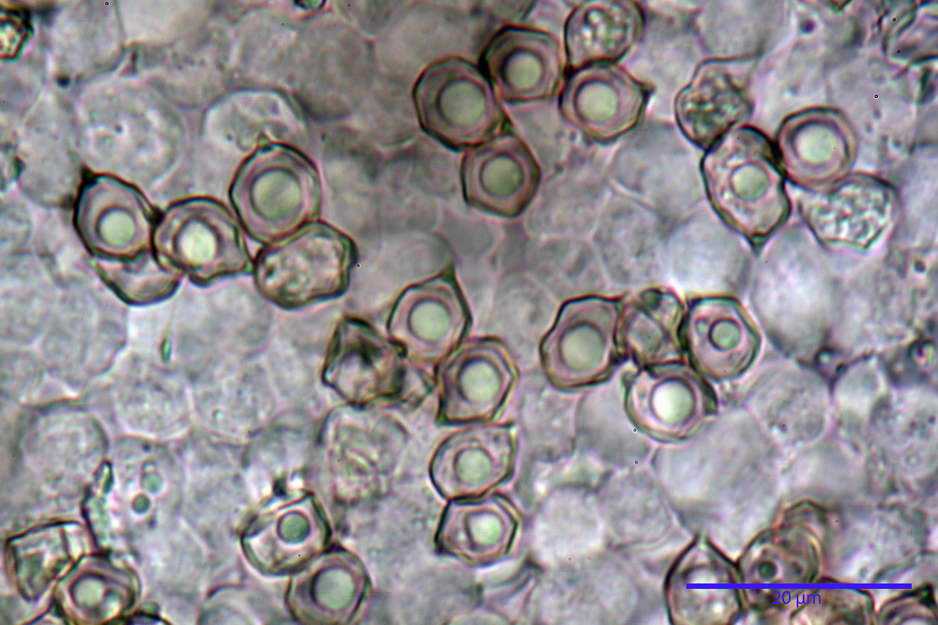
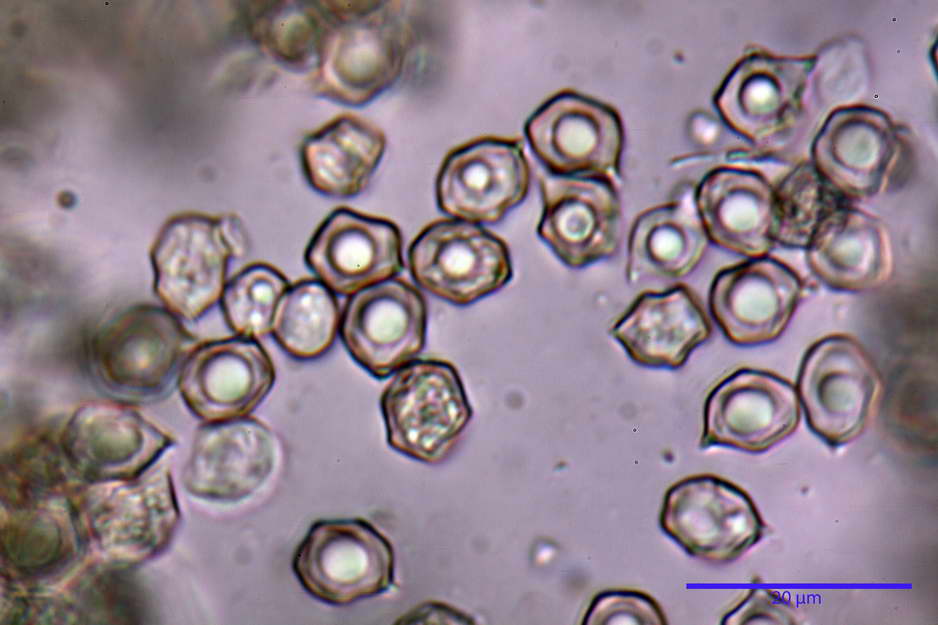
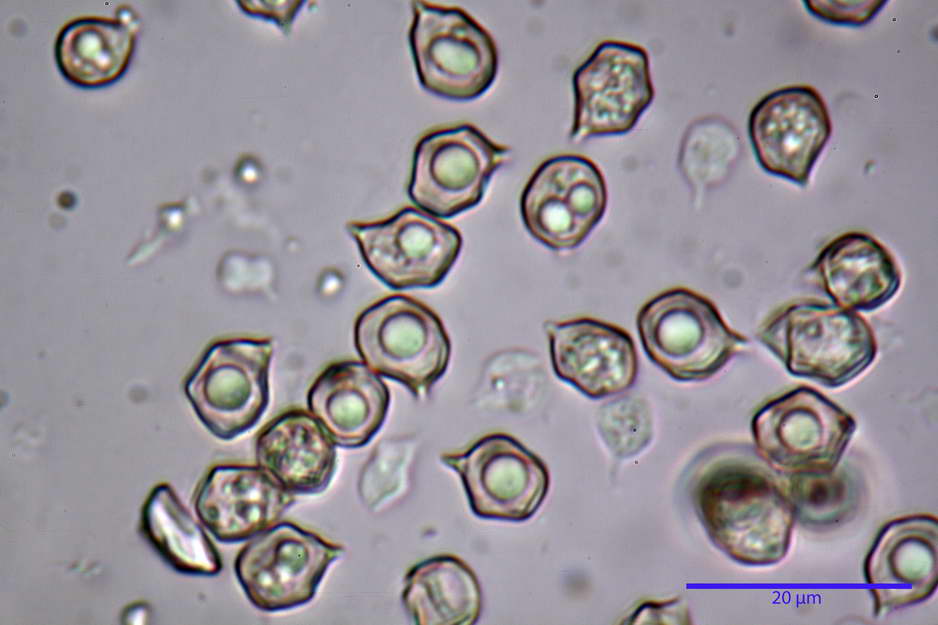
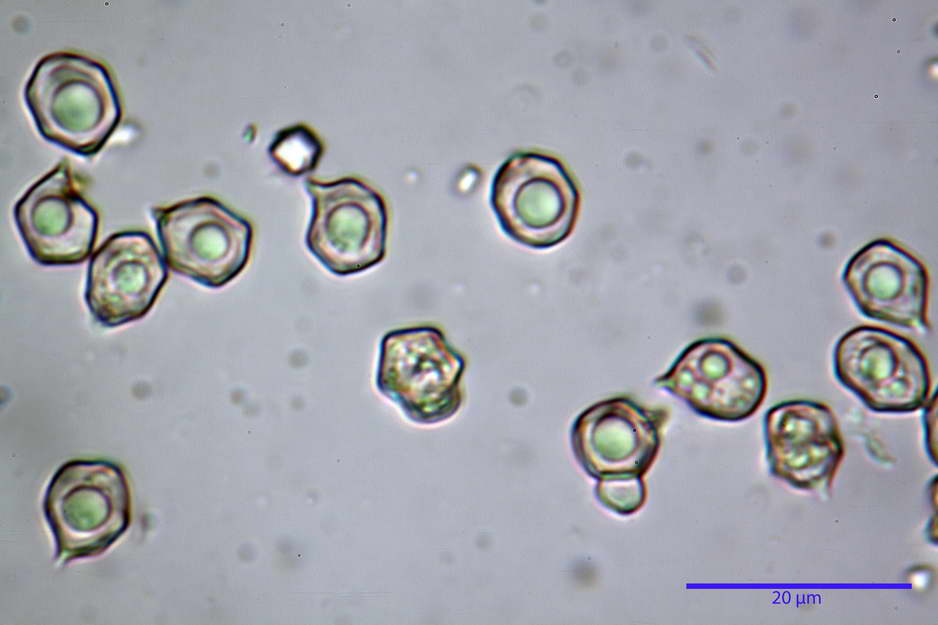
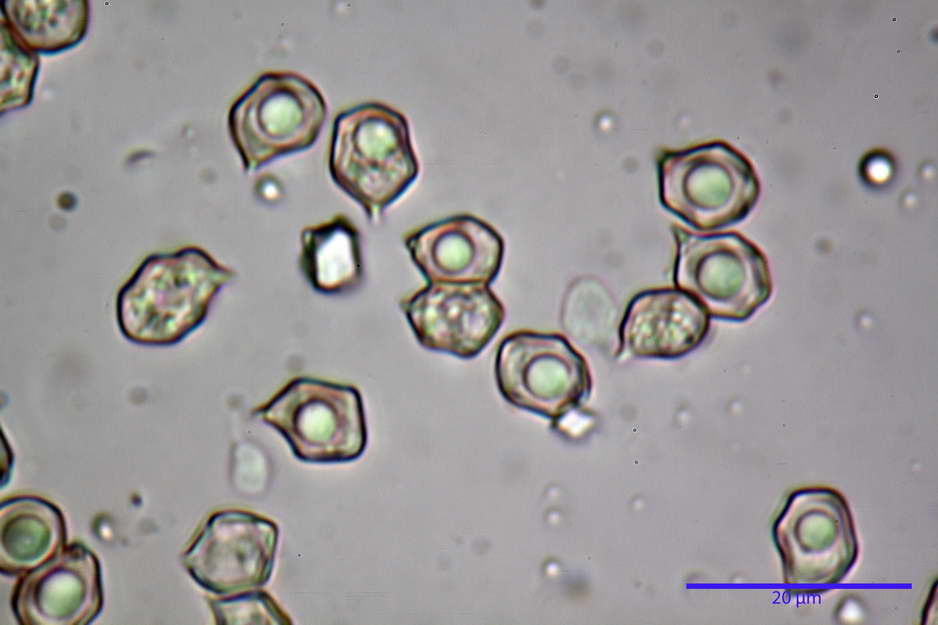
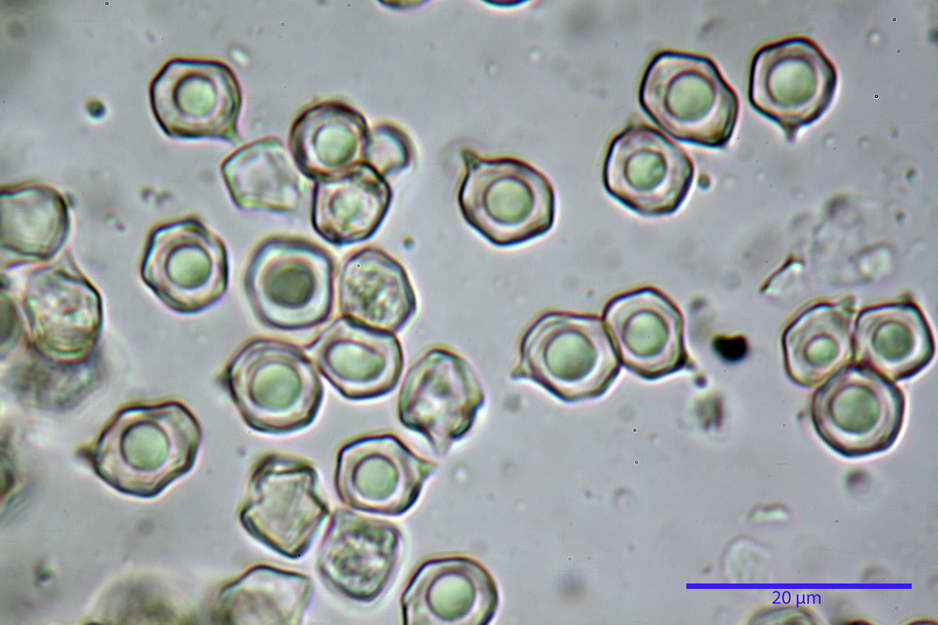
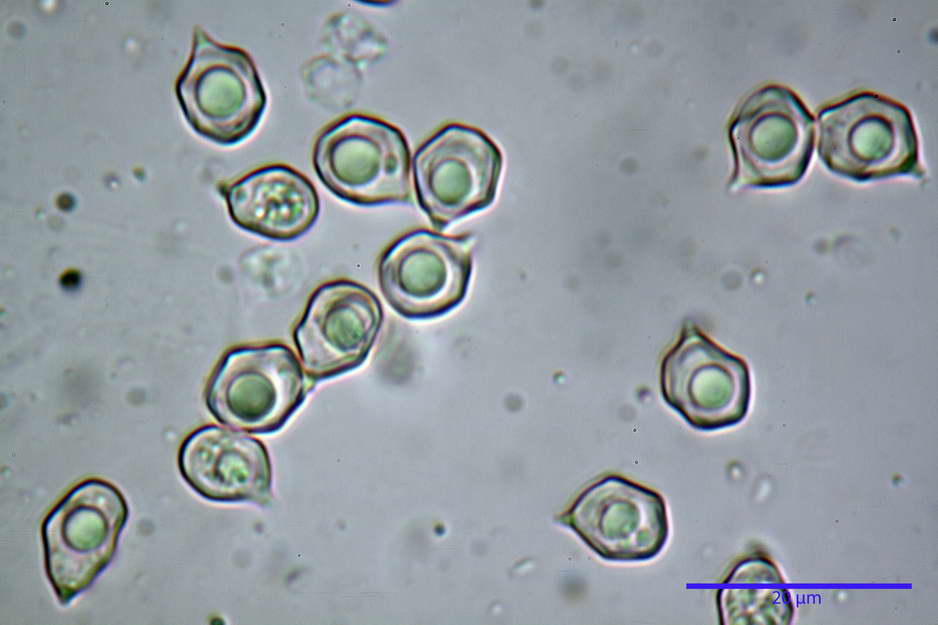
Spore (7,63) 8,45-10,09 (10,96) x (6,52) 6,79-8,03 (8,30) µm, in media 9,19 x 7,46 µm; Q. = (1,00) 1,12-1,36 (1,54), Q.m = 1,23; Vol. = (187) 218-326 (365), Vol.m = 269 µm³; da subisodiametriche a eterodiametriche, con 5-6-7 angoli in proiezione laterale.
Basidi (27,18) 29,65-38,64 (39,79) x (10,07) 10,23-12,18 (12,25) µm; in media 34,17 x 11,26 µm, Q.m = 3,04; Vol.m = 2278 µm³; tetrasporici, cilindrico claviformi, con giunto a fibbia basale.
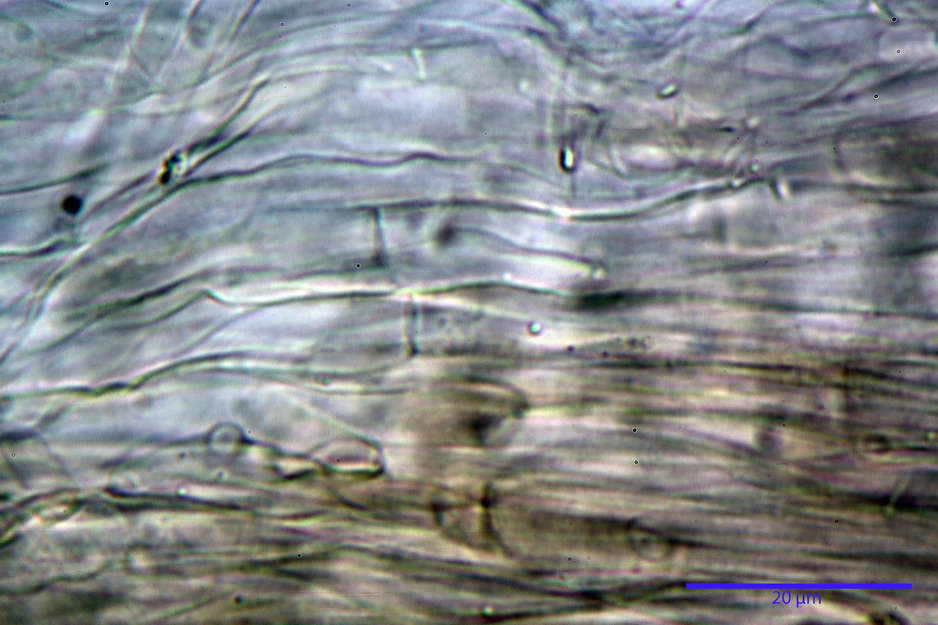
Trama lamellare parallela, formata da ife cilindriche, settate, con diametro (6,84) 6,98-9,77 (10,71) µm, ialine o con leggero pigmento intracellulare e parietale molto finemente incrostante.
Cheilocistidi assenti.
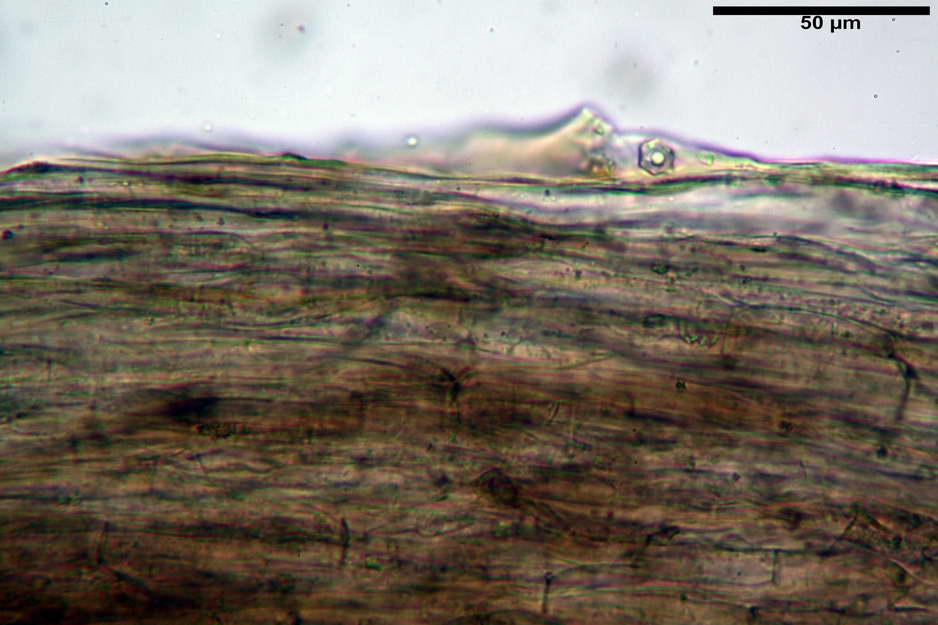
Pileipellis costituita da una cutis di ife cilindriche con diametro di (2,06) 2,46-11,28 (13,75) µm, in H2O si evidenzia un pigmento intracellulare grigio-brunastro e parietale fortemente incrostante, di colore bruno scuro. Pileocistidi non osservati.
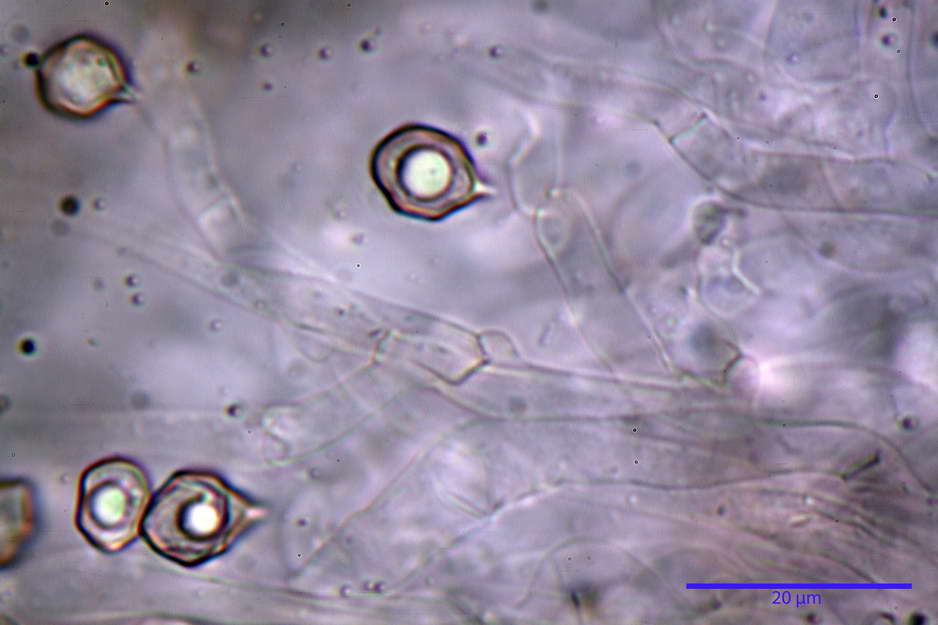
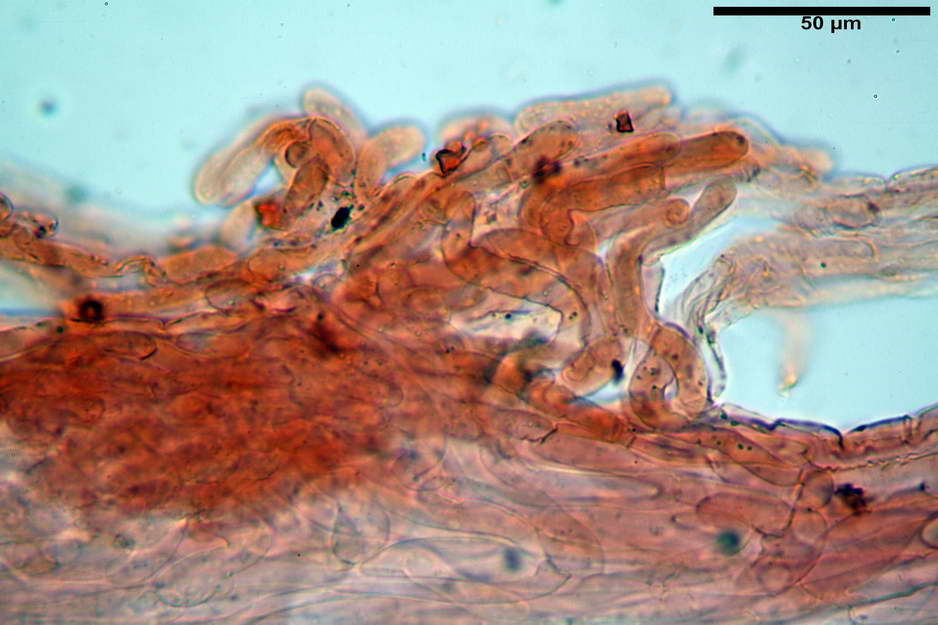
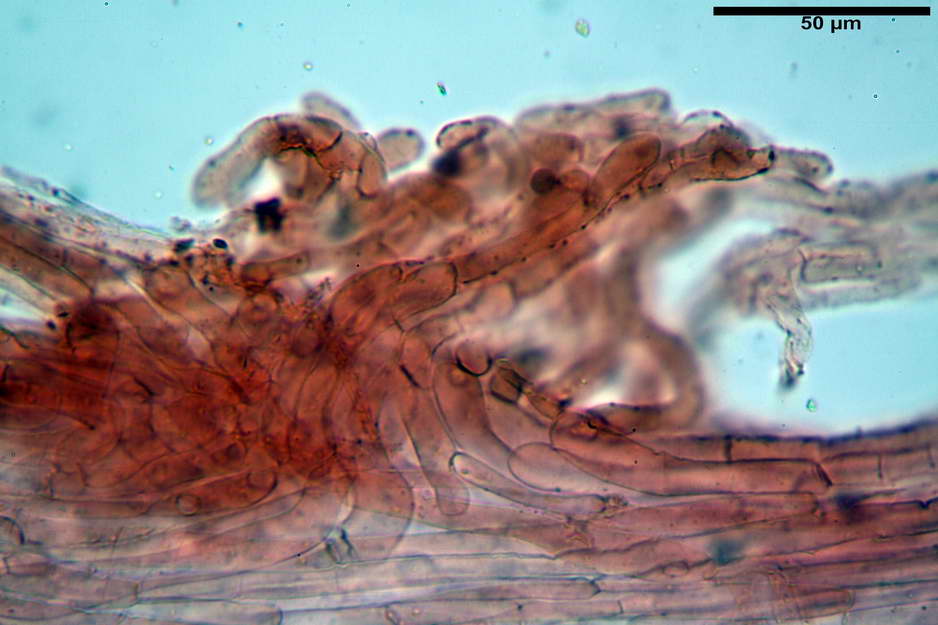
Stipitipellis costituita da una cutis di ife cilindriche con diametro di (4,38) 4,941-10,087 (11,83) µm, presente un pigmento intracellulare di colore brunastro e parietale, fortemente incrostante, del medesimo colore.
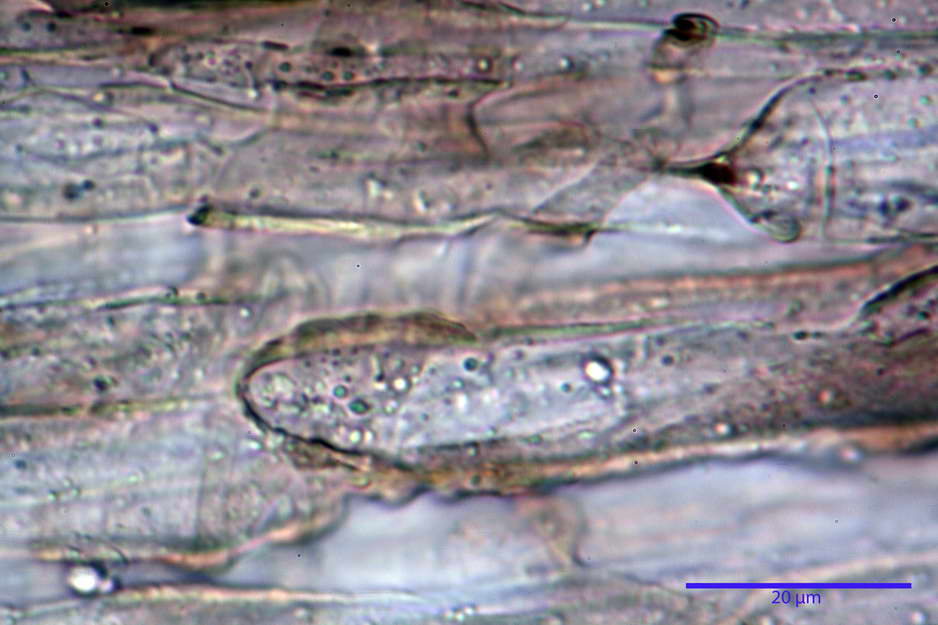
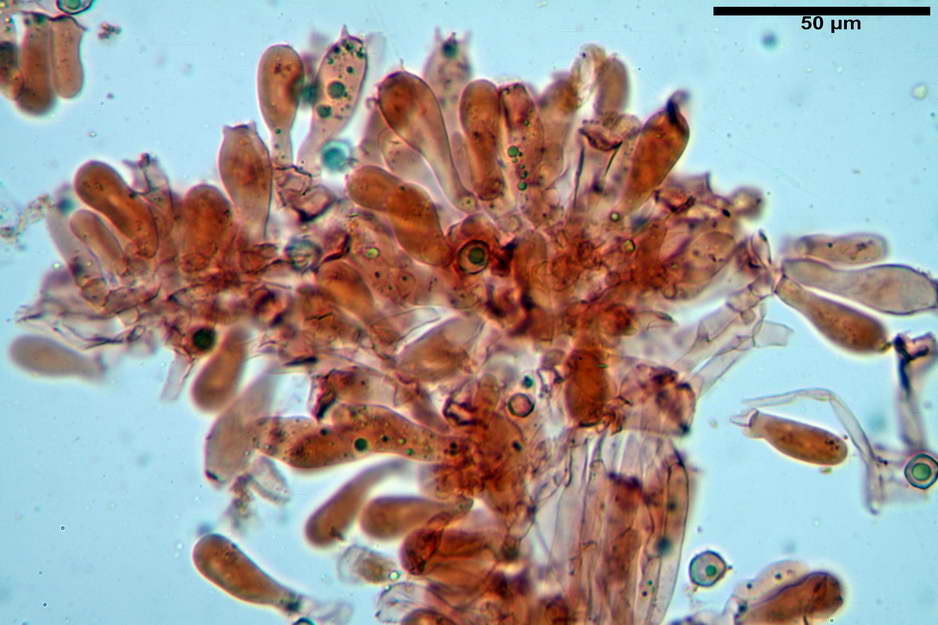
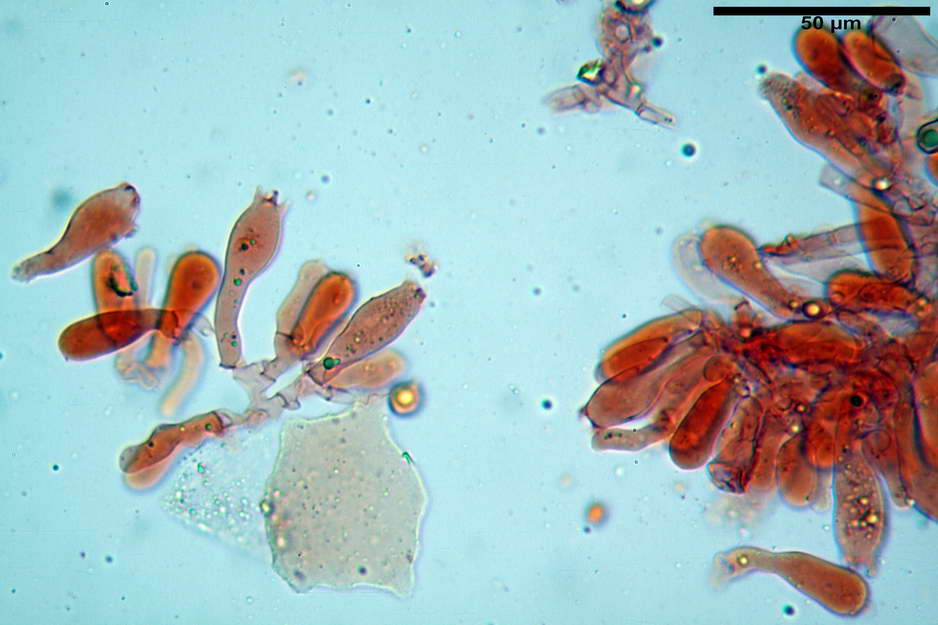
Caulocistidi (33,21) 33,81-64,50 (67,00) x (5,19) 5,42-8,83 (9,62) µm, apice (5,90) 5,98-10,54 (10,98) µm, in media 45,57 x 6,93 µm, apice, in media 8,00 µm, flessuosi, da cilindrici a subcilindrici, apice di pari spessore o di poco più largo, piuttosto rari, disposti in mazzetti all'estremo apice dello stipite, assenti già pochi millimetri più in basso.
Giunti a fibbia presenti nell'imenio e nel subimenio, non osservati altrove.
Materiali e Metodi
Lo studio è stato compiuto su materiale secco; quest'ultimo, reidratato con NH4OH 6%, H2O, secondo necessità.
I preparati sono stati osservati usando come mezzo di governo H2O; ove necessario, si è adoperato Rosso Congo Ammoniacale 6% per meglio evidenziare le differenti tipologie cellulari.
Le misure microscopiche sono state eseguite con il software di calcolo Mycométre gentilmente fornitoci dal Sig. Georges Fannechère e prelevabile a questo indirizzo [url="http://mycolim.free.fr/DOC_SML/mycm202/Mycm2.Installe.exe"%5D%5Bsize="2"]http://mycolim.free.fr[/size][/url]. Le misure sporali si riferiscono a 100 unità, effettuate in proiezione laterale senza tener conto dell'apiculo o, nel caso di spore inequilaterali, anche in proiezione frontale, ottenute da sporata o prelevate da altre zone non imeniali, scartando spore ancora evidentemente immature e senza tenere conto di eventuali ornamentazioni che, nel caso, si sono misurate a parte, per le rimanenti tipologie cellulari si sono eseguite un minimo di venti misure a tipologia.
Per la terminologia riguardante la tipologia delle caratteristiche macro e microscopiche, si fa riferimento a Else C. Vellinga1998: Flora Agaricina Neerlandica 1- Chapter 8; Glossary.
Per quanto riguarda la nomenclatura aggiornata ed i nomi degli Autori, abbiamo fatto riferimento a http://www.indexfung...names/Names.asp e[url="http://www.mycobank.org/MycoTaxo.aspx"%5D%5Bsize="2"]http://www.mycobank.org/MycoTaxo.aspx[/size][/url] .
Per le osservazioni dei caratteri macroscopici, in alcuni casi, ci siamo valsi di uno stereo microscopio Optech trinoculare e del supporto di foto macro ad alta risoluzione. Le foto concernenti la microscopia, sono state eseguite con l'ausilio di una fotocamera Reflex EOS 50D, posto sul terzo occhio del trinoculare di un microscopio biologico Optech Biostar B5, supportato da ottiche Plan-APO, illuminazione alogena 12V-50 W a luce riflessa, con regolatore d'intensità. Le collezioni d'erbario sono conservate nell'erbario A.M.B. Gruppo di Muggia e del Carso.
Dati di raccolta e Habitat. N. scheda: 4655. Data di ritrovamento: 16/09/2010. Località: Stazzi di Jacci di Verre. Comune: Rocca Santa Maria. Coordinate geografiche: 339; III; TERAMO. Altezza s.l.m.: f. 5. Habitat: nei pressi di una faggeta, nel prato, fuori dal bosco. Determinatore: Zugna M. Legit: de Ruvo B.
Data inserimento in erbario: 02/05/2011
Osservazioni
Per la somma delle caratteristiche microscopiche sopra descritte, E. vernum, si colloca nel Sottogenere Nolanea (Fr.: Fr.) Noordel., Sezione Papillata (Romagn.) Noordel., Sottosezione Cosmeoexonema (Largent & Thiers), assieme ad altre cinque entità delle quali, di seguito, evidenziamo sinteticamente le principali differenze macro e/o microscopiche.
Entoloma sacchariolens (Romagn.) Noordel. 1980, microscopicamente, possiede cheilocistidi, spore leggermente più strette, con Q.m 1.3. A livello olfattivo si riconosce per l’odore di deodorante per wc, simile a quello di Hebeloma sacchariolens.
Entoloma ameides (Berk. & Broome) Sacc.1887, privo di cheilocistidi, possiede spore leggermente più strette, con Q.m 1.25, ed una pileipellis con ife solo finemente incrostate, possiede anch’esso lo stesso odore di deodorante per wc
Entoloma sericeum (Bull.) Quél. 1872, privo di cheilocistidi, possiede spore isodiametriche, con Q.m 1.1 un forte odore di farina.
Entoloma sphaerocystis Noordel. 1980, possiede cheilocistidi da largamente claviformi a globosi.
Entoloma tibiicystidiatum Arnolds & Noordel. 1979, possiede cheilocistidi tibiformi.
Solitamente, nel Genere Entoloma, salvo in poche specie, non si fa cenno della presenza o assenza di caulocistidi in quanto non è uso investigare la stipitipellis. Nel caso di E. vernum si fa riferimento a caulocistidi capitulati “abbondanti?” presenti nella zona alta dello stipite (Noordel. 1992-2004).
Nell’investigare la stipitipellis possiamo dire di aver notato ben pochi e rarefatti (caulocistidi “veri?”), in quanto essi avevano più la forma di semplici ife della stipitipellis con terminale prono o appena rialzato e leggermente allargato, al punto che forse sarebbe meglio chiamarli peli caulostipitali o pseudocaulocistidi.
Mentre in una raccolta di E. hirtipes, del quale non si cita mai la presenza di caulocistidi, abbiamo riscontrato folti gruppi di cheilocistidi capitulati veri, situati nella porzione alta dello stipite, discendenti, per un buon tratto.
Forse, l’aspetto della stipitipellis non è stato indagato perché ritenuto non significativamente valido dal punto di vista tassonomico, forse perché instabile, o troppo monotono nei suoi caratteri.
Comunque, sarebbe bene, quando si descrive una specie, annettere quante più informazioni e dati possibili, senza omettere nulla, altrimenti, come nel caso di E. hirtipes e E. vernum, sembrerebbe che la presenza/assenza dei caulocistidi possa essere un buon carattere di distinzione, in quanto, dalla bibliografia sui generis, si è propensi a ritenere che il primo non possegga caulocistidi, visto che non vengono mai citati (ed invece ci sono e sono anche abbondantissimi), mentre nel secondo ci siano in abbondanza (invece ce ne sono pochi e anche malformati).
Bibliografia consultata
Breitenbach, J., KrÄnzlin, F., 1995: Champignons de Suisse. Tome 4. - Lucerne: Mykologia.
Consiglio,G.1997: Contributo alla conoscenza dei macromiceti dell'Emilia-Romagna. IV. Genere Entoloma. XL (1): 3
Consiglio,G. 2000: Contributo alla conoscenza del Genere Entoloma. Parte seconda. XLIII (3): 211-226
Noordeloos, M.E., 1992: Entoloma s.l. - Saronno: Giovanna Biella.
Noordeloos, M.E., 1998: Flora Agaricina Neerlandica n° 1: 96-97.
Noordeloos, M.E., 2004: Entoloma s.l. Supplemento. - Alassio: Massimo Candusso.

photo by: Bruno de Ruvo
photo by: Bruno de Ruvo
photo by: Bruno de Ruvo
photo by: Bruno de Ruvo



 Questa discussione è bloccata
Questa discussione è bloccata