per quanto riguarda la misurazione delle spore
#1

Inviato 19 febbraio 2008 - 23:53
Voglio anticipare che, si tratta solo di un'esempio e che, in questo caso le spore sono state misurate all'interno degli aschi, cosa che non va assolutamente fatta.
Le spore degli ascomiceti vanno misurate dopo ave fatto sporulare gli ascomi, usando i metodi che tutti conosciamo.
Non va bene nemmeno misurare spore dopo schiacciamento in quanto le spore che troveremo libere saranno quasi sicuramente uscite per rottura degli aschi e non per sporulazione spontanea, di questo ce ne accorgeremmo dando un occhiata agli aschi e notando che, molti di questi invece di essere vuoti ed avere l'apice sprovvisto di opercolo o con questo posto su un lato, li troveremo spezzati e lacerati.
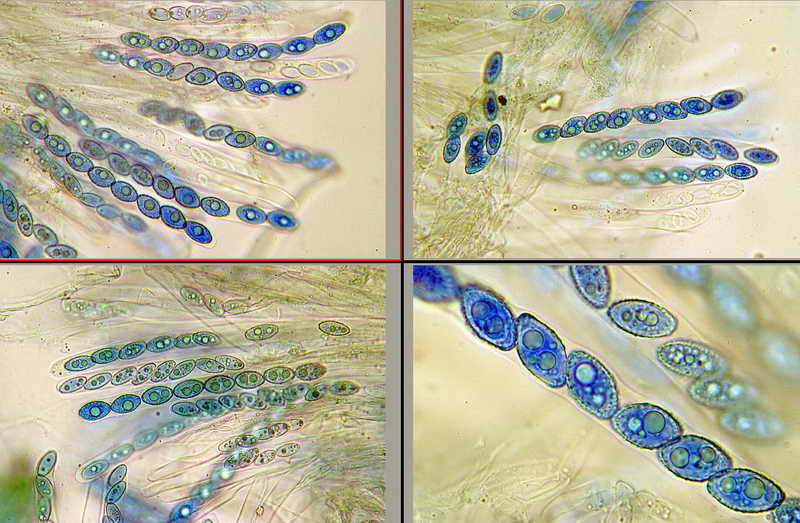
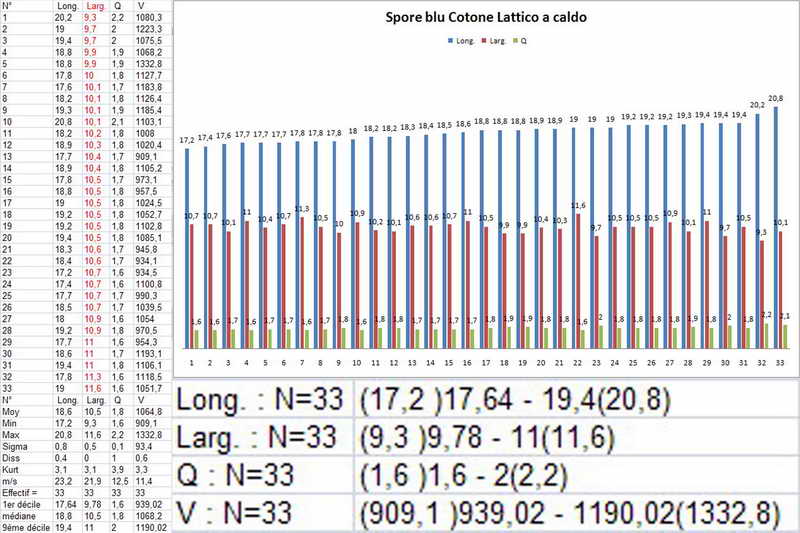
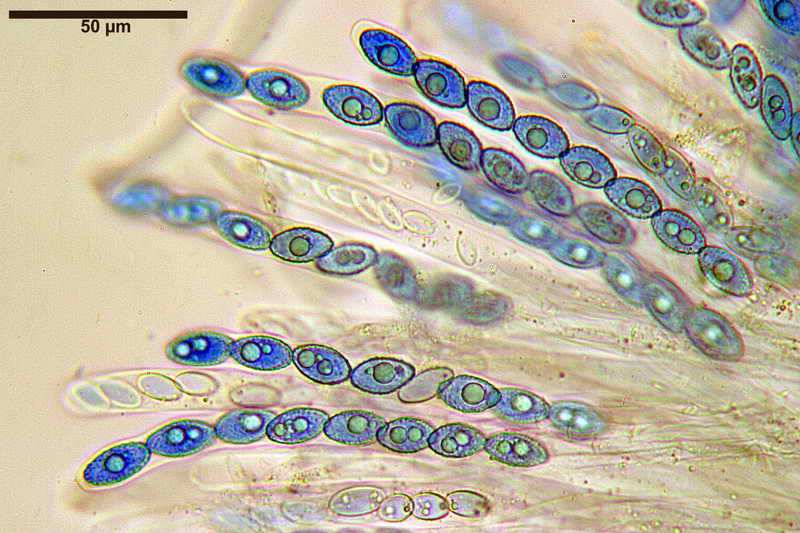
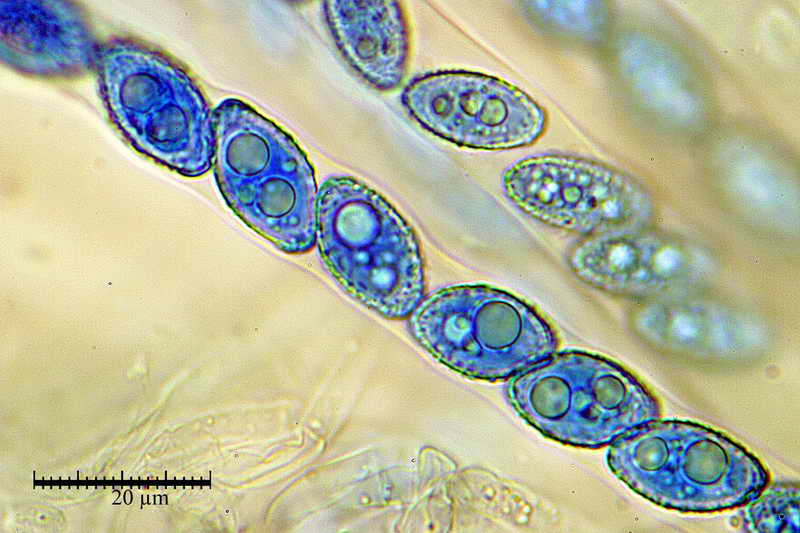
Bene, ora veniamo finalmente a quello che vi volevo mostrare, si tratta, come accennato sopra, al fatto di effettuare la misurazione sporale dopo aver usato il blu cotone lattico a caldo, come vedremo, questa operazione provoca un repentino ingrossamento "soprattutto nella larghezza", ma anche nella forma delle spore, falsando i dati finali e inducendo l'osservatore all'osservazione di spore con forme e misure sicuramente non consone alla specie.
Il sistema che va usato per la misurazione corretta delle spore, in caso di essiccata, la reidratazione in H2O e l'osservazione con lo stesso liquido o, al limite usando rosso congo anionico o ancora floxina acquosa, in poche parole, nessun reidratante che possa rigonfiare le spore più del dovuto.
Il Blu Cotone lattico a caldo andrà usato soltanto per l'osservazione delle ornamentazioni sporali o altre osservazioni ma assolutamente no per fare qualsivoglia misura.
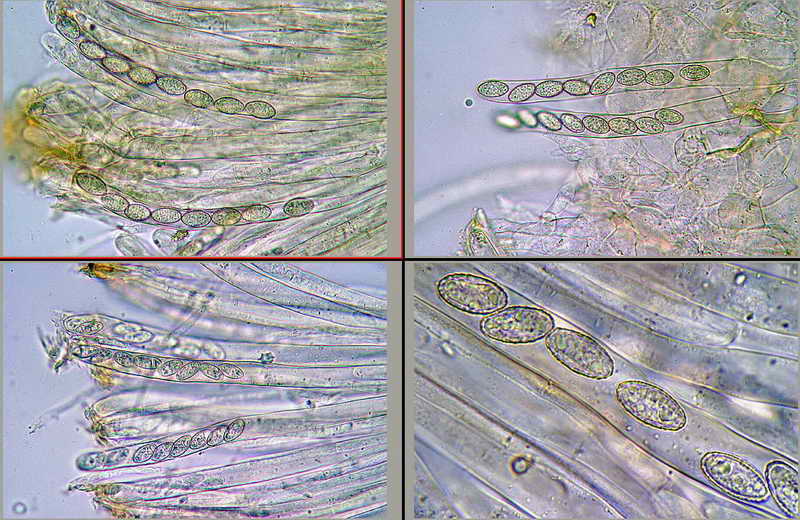
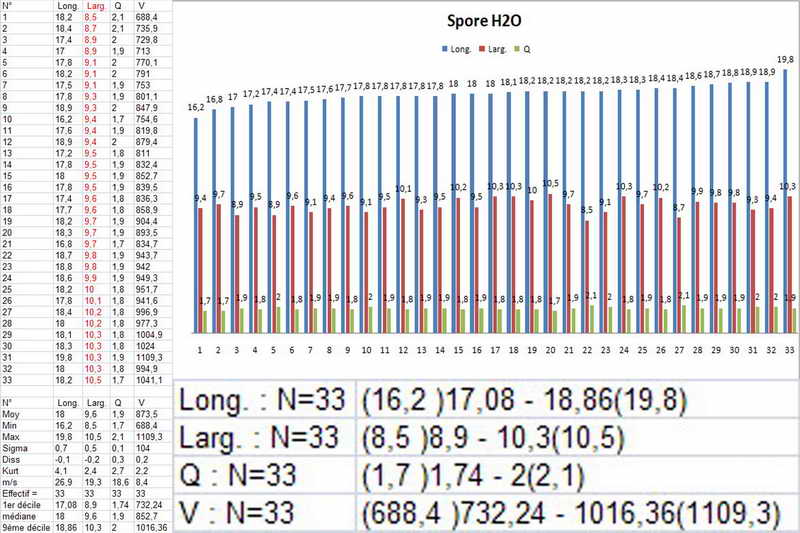
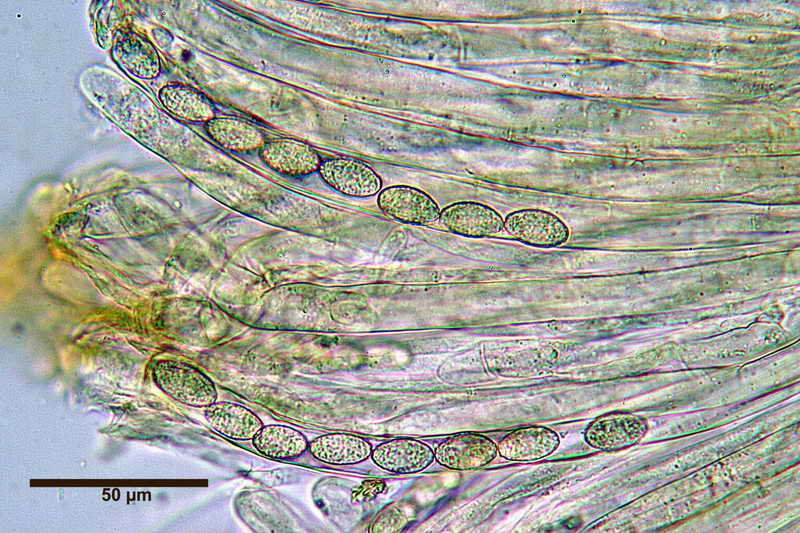
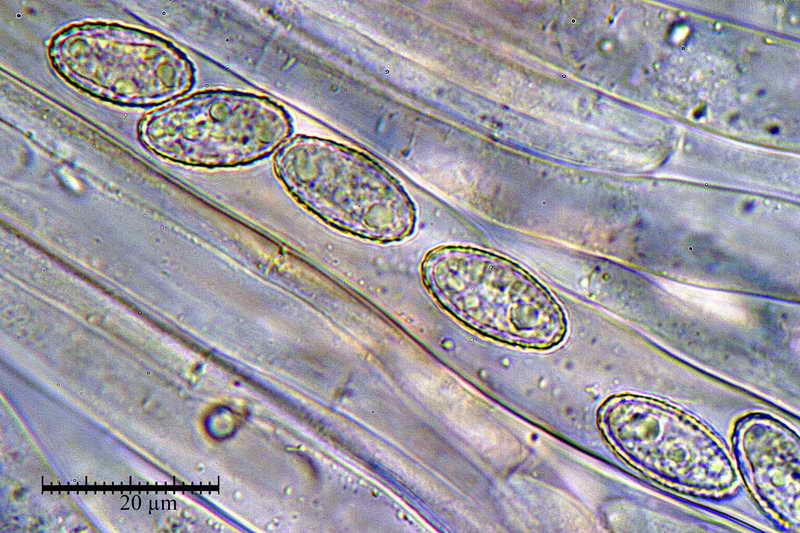
Di seguito posterò alcune foto e la misure di una raccolta di Peziza phyllogena, reidratata in H2O, osservata sempre in H2O.
Quindi, dopo aver proceduto con il procedimento Blu Cotone Lattico a caldo, rifatto le foto e le misure, sempre allo stesso preparato.
Nella foto la specie usata per l'osservazione.
Marino Zugna
A.M.B. Gruppo di Muggia e del Carso
#12

Inviato 20 febbraio 2008 - 00:04
Si osservi soprattutto la stabilità nella forma delle spore in H2O e, al contrario, la diversità in quelle trattate con Blu Cotone Lattico a caldo.
A questo punto, se non avessimo fatto la verifica della forma in H2O, come ci saremo comportati con le diverse forme che si trovano nel preparato in Blu Cotone Lattico a caldo? Quale avremo accettato come forma stabile?
Sara una cavolata ma, alle volte ci si perde in un bicchier... di vino
Marino Zugna
A.M.B. Gruppo di Muggia e del Carso
#13

Inviato 20 febbraio 2008 - 00:10
Marino Zugna
A.M.B. Gruppo di Muggia e del Carso
#14

Inviato 20 febbraio 2008 - 00:12
Ciao
Gianni
#15

Inviato 20 febbraio 2008 - 00:29
La stessa cosa vale anche per i basidiomiceti, anche se, a parte la rilevazione dei pigmenti pileici di Russula e Cortinarius, per cui si usa H2O e le incrostazioni in Entoloma e qualche altro genere, per i quali si usa una soluzione satura di glucosio, per tutto il resto "o quasi", si può benissimo reidratare con KOH2% o con ammoniaca 5%.
Logicamente, ci sono specie in cui va usata una tecnica specifica, ma questo è un altro discorso e andrebbe fatto ogni volta che ne capita l'occasione, vedi la carminiofilia, la siderofilia, la metacromasia, la, la, la, va be dai, altrimenti non la finiamo più.
Marino Zugna
A.M.B. Gruppo di Muggia e del Carso
#16

Inviato 20 febbraio 2008 - 00:36
Allora, quanto deve stare? Deve stare poco, quanto poco? Quel tanto che basta.
La pratica derivata dall'esperienza e da molti tentativi ti aiuterà a capire quando sarà il momento giusto. Io adesso non te lo saprei dire, anche perchè quando ho tentato di rilevare i pigmenti nei secchi di russola ho sempre baccannato da matti, però qualcosina sono riuscito ad ottenerla, in ogni modo, non puoi certo mettere il preparato in ammollo ed andartene a cena fuori.
Devi invece, tenerlo bene d'occhio e, quando, dopo averlo sollecitato con la punta di un ago vedrai che sta rilasciando i pigmenti, ebbene, allora sarà gia un attimino troppo tardi, quindi, rifai il tutto e preleva il pezzo un attimo prima che li rilasci.
Semplice vero?
Marino Zugna
A.M.B. Gruppo di Muggia e del Carso
#17

Inviato 20 febbraio 2008 - 08:47
Grazie Marino.Ciao.
Nicandro
Cagliari
#18

Inviato 20 febbraio 2008 - 13:30
Dopo aver prelevato un pezzettino di imenoforo, se da essiccata bisogna prima reidratarlo, lo si depone su un vetrino portaoggetti o, ancora meglio, al centro di un vetrino di orologio, quindi si lasciano cadere sopra alcune gocce di Blu Cotone Lattico, fatto ciò, si pone il tutto sopra una fonte di calore (un accendino o, meglio, una candela*), per il tempo necessario affinché il liquido bolla per alcuni secondi, aggiungendo, se necessario altre gocce di liquido se questo evapora troppo rapidamente o si disperde sulla superficie del vetrino.
Finita questa procedura si preleva il pezzetto di imenoforo e si passa al suo lavaggio, con H2O, infine si osserva il preparato "con metodo squash", usando come liquido di governo sempre H2O oppure, se si preferisce, Cloralio idrato.
* attenzione che, oltre a scottarvi, se non usate qualche precauzione (usate una pinzetta) e mantenete il vetrino a contatto del fuoco per un tempo troppo prolungato, esso potrebbe esplodere a causa del calore provocando e provocandoVi spiacevoli danni, quindi usate la cautela di portare ad ebollizione il liquido con brevi frazioni di tempo.
Dimenticavo, non annusate i vapori di Acido Lattico... fanno schifo.
Un consiglio spassionato, spendete 33 € per il Manuale di microscopia dei funghi - BASSO M.T. (2005), sono soldini ben spesi
Tutto quì
Marino Zugna
A.M.B. Gruppo di Muggia e del Carso
#19

Inviato 20 febbraio 2008 - 14:04
Nicandro
Messaggio modificato da Nicandro, 20 febbraio 2008 - 14:04
Cagliari
#20

Inviato 20 febbraio 2008 - 15:21
vedi il capitolo "cianifilia", pag. 72 e seguentiIl manuale ce l'ho già da tempo e del metodo di osservazione a caldo M.T.Basso ne parla a proposito della colorazione dei nuclei. Io desideravo solo conoscere qual'era il tuo metodo. Ora mi è chiaro perchè descritto in modo più esauriente.Grazie.
Nicandro
Marino Zugna
A.M.B. Gruppo di Muggia e del Carso
#21

Inviato 21 febbraio 2008 - 00:18
La differenza non è ENORME, ma nonostante ciò è evidente e, a mio avviso, significativa.
Si osservi soprattutto la stabilità nella forma delle spore in H2O e, al contrario, la diversità in quelle trattate con Blu Cotone Lattico a caldo.
A questo punto, se non avessimo fatto la verifica della forma in H2O, come ci saremo comportati con le diverse forme che si trovano nel preparato in Blu Cotone Lattico a caldo? Quale avremo accettato come forma stabile?
Sara una cavolata ma, alle volte ci si perde in un bicchier... di vino:mago!:
scusa Marino...
ma come si fa a essere sicuri che la forma stabile = reale non sia quella osservata/reidratata in acqua piuttosto che quella osservata in blu cotone a caldo ? In altre parole mi chiedevo se il riscaldamento del preparato e del colorante(blu lattico) fino a ebollizione possano in qualche modo alterarne il risultato rendendolo sicuramente più evidente, ma si può considerare allo stesso tempo anche reale ? Che diiferenza ci sarebbe poi usando il blu lattico a freddo?
Un altra domanda : perchè allora per analogia non si usa o si è pensato per es. di scaldare il Melzer per vedere meglio per es. le ornamentazioni sporali in Russula ?
Scusa di nuovo Marino per tutte queste domande, ma la curiosità era troppo.
grazie
ciao
#22

Inviato 21 febbraio 2008 - 00:35
per l'appunto è quella in acquascusa Marino...
ma come si fa a essere sicuri che la forma stabile = reale non sia quella osservata/reidratata in acqua piuttosto che quella osservata in blu cotone a caldo ?
e non quella in blu lattico.
Osserva come le spore in acqua siano tutte e sempre di forma identica "non badare alle misure", mentre quelle altre abbiano diverse forme, che vanno da ellittiche fino a diventare largamente fusoidi.
E' proprio questo che intendevo far osservare, cioè. la differenza di forme che le spore assumono in blu lattico, e la stabilità delle stesse, in H2O.
certo che lo altera, infatti si deve usare per l'osservazione delle ornamentazioni che, altrimenti non si possono apprezzare, e non per le misure.In altre parole mi chiedevo se il riscaldamento del preparato e del colorante(blu lattico) fino a ebollizione possano in qualche modo alterarne il risultato rendendolo sicuramente più evidente, ma si può considerare allo stesso tempo anche reale ?
si usa riscaldare perchè il colorante attecchisce meglio alle parti "cianofilie", delle spore che, in questo caso sono le ornamentazioni. Si fa anche a freddo ma, bisogna lasciare agire per molte ore e alle volte, neanche dopo molto tempo il colorante non attechisce rendendoo vana l'operazione.Che differenza ci sarebbe poi usando il blu lattico a freddo?
perchè queste si vedono bene alche senza il riscaldamento, e non è che sia molto comodo dover riscaldare il preparato per poter vedere qualcosa.Un altra domanda : perchè allora per analogia non si usa o si è pensato per es. di scaldare il Melzer per vedere meglio per es. le ornamentazioni sporali in Russula ?
inoltre il melzer non è un colorante, o meglio, non solo, in quanto, principalmente è stato creato e viene usato come reagente.
de nadaScusa di nuovo Marino per tutte queste domande, ma la curiosità era troppo.
prego, ciaograzie ciao
Marino Zugna
A.M.B. Gruppo di Muggia e del Carso
#23

Inviato 21 febbraio 2008 - 00:42
Quello che altera le spore è, il calore.
Marino Zugna
A.M.B. Gruppo di Muggia e del Carso
0 utente(i) stanno leggendo questa discussione
0 utenti, 0 ospiti, 0 utenti anonimi


 Questa discussione è bloccata
Questa discussione è bloccata